Premier organe fonctionnel de l’embryon, le cœur en assure la survie. Le développement du cœur est très finement régulé par une multitude de protéines nommées « facteurs de transcription », qui contrôlent l’activation ou la répression de certains gènes [ 1]. Grâce à l’action de ces facteurs de transcription, une cellule cardiaque exprime des gènes propres au cœur. On n’avait pas encore démontré que les facteurs de transcription que l’on savait importants pour l’embryon, le sont aussi pour l’adulte, une fois le cœur formé. L’équipe de notre laboratoire, en collaboration avec des collègues de l’Université de Toronto, a découvert le rôle majeur du facteur de transcription nommé Irx5 dans la régulation des battements du cœur [ 2].
Les maladies cardiaques constituent la cause la plus fréquente de décès dans le monde industrialisé. À cet égard, l’une des plus importantes causes de mort subite à tous les âges est l’arythmie cardiaque. Il s’agit d’une maladie très grave qui peut frapper sans avertissement ; elle affecte particulièrement les personnes qui souffrent d’une insuffisance cardiaque, consécutive, par exemple, à un infarctus. Ces personnes sont atteintes d’arythmies qui risquent d’entraîner leur décès et exigent l’implantation d’un pacemaker/défibrillateur. Le plus souvent, c’est un défaut de repolarisation qui induit les arythmies [ 3]. La repolarisation des cellules cardiaques constitue le mécanisme par lequel les cellules se remettent à zéro après chaque contraction ; ce mécanisme s’accomplit grâce à l’extrusion d’ions potassiques à travers des canaux potassiques localisés dans la membrane plasmique. De fait, la repolarisation ordonnée des cellules cardiaques s’effectue via la présence d’un gradient de repolarisation qui est lui-même la conséquence du gradient d’expression du courant potassique I TO (transient outward current). Celui-ci est plus important dans l’épicarde que dans l’endocarde [ 4]. Néanmoins, le mécanisme qui établit ce gradient restait à élucider.
En examinant des souris chez lesquelles le gène Irx5 avait été invalidé (Irx5−/− ), nous avons constaté qu’elles paraissaient n’avoir aucune anomalie cardiaque ; cependant, leur électrocardiogramme laissait entrevoir un défaut de repolarisation. En effet, en stimulant leur cœur comme en réponse à un stress, les souris Irx5−/− manifestaient des arythmies, tandis que le cœur des souris normales continuait de battre normalement. Cette tendance à développer des arythmies sous condition de stress est précisément ce qu’on observe chez les patients cardiaques ; ces derniers, en effet, ne souffrent pas d’arythmies constamment, ils les développent en condition de stress durant un effort physique, par exemple, ou par suite de tension psychologique. En examinant, par la technique du patch-clamp, la fonction de canaux potassiques dans des cellules cardiaques isolées, nous avons effectivement observé que le courant I TO était élevé dans les cellules de l’endocarde. Dès lors, deux conclusions se profilaient : premièrement, Irx5 régule le gradient et deuxièmement une augmentation locale d’I TO entraîne une susceptibilité aux arythmies. Cette dernière observation est assez importante, car le lien entre le gradient d’I TO et les arythmies demandait alors à être clairement et définitivement établi. [ 5].
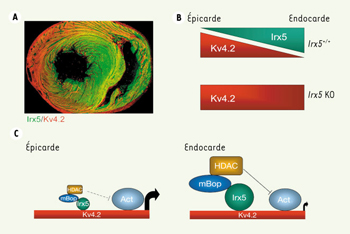
Mais comment Irx5 régule-t-il I TO ? Le gradient d’I TO s’installe via le gradient d’expression du gène Kv4.2, qui produit la protéine principale du canal potassique I TO. Irx5 est exprimé en un gradient inverse de celui de Kv4.2 : là où Irx5 est fortement exprimé se trouvent de faibles niveaux de Kv4.2 et inversement (Figure 1A). Dans un modèle de cellules en culture, cette relation inverse prend un sens : si on augmente les niveaux de Irx5 dans des cellules cardiaques, l’activation du promoteur du gène Kv4.2 est réduite. Et dans les cœurs de souris Irx5−/− , les niveaux de protéine Kv4.2 augmentent dans les régions où Irx5 est normalement exprimé de façon maximale (Figure 1B). Irx5 agit donc pour réprimer l’expression de Kv4.2, et le gradient d’expression de Irx5 produit à son tour un gradient inverse dans l’expression de Kv4.2.
| Figure 1.
A. Gradients de Irx5 (vert) et Kv4.2 (rouge) dans un cœur de souris normale (adapté de [2]). B. Représentation des gradients opposés de Irx5 et Kv4.2, indiquant l’augmentation de l’expression de Kv4.2 chez les souris Irx5−/−
. C. Mécanisme d’action de Irx5 (voir texte). |
L’histoire se corse un peu lorsqu’on constate que Irx5 augmente l’expression de Kv4.2 dans les cellules des autres tissus ! Ce paradoxe a été expliqué très simplement : Irx5 interagit avec une protéine propre aux cellules cardiaques qui fonctionne comme répresseur d’activité transcriptionnelle. Cette dernière protéine, nommée mBop [ 6], recrute des protéines qui modifient la chromatine (nommées histone désacetylases ou HDAC) pour réduire l’activité d’un gène cible. Donc, dans les cellules cardiaques, Irx5 se lie au gène Kv4.2, interagit avec mBop, qui à son tour recrute les HDAC, pour finalement réduire complètement l’expression de Kv4.2 (Figure 1C). Puisque Irx5 est exprimé dans un gradient, ce mécanisme forme un gradient inverse de I TO, qui permet la relaxation du cœur de façon ordonnée à la fin de chaque contraction. Sans cette fine régulation, des arythmies s’ensuivent. Voilà pourquoi toute perturbation de ce mécanisme pourrait être à la source des arythmies qu’on trouve chez des patients qui souffrent d’insuffisance cardiaque ou de toute autre maladie qui prédispose aux arythmies cardiaques.
Un détail important restait à élucider : le cœur de la souris n’est pas identique à celui de mammifères plus grands comme l’homme ou le chien, surtout en ce qui concerne la nature moléculaire du courant I TO. Mais en examinant la distribution de Irx5 dans le myocarde du chien, nous avons observé que son gradient est semblable à celui de la souris, ce qui suggère que son rôle pourrait être important aussi pour réguler le gradient de repolarisation ; une observation comparable pourrait éventuellement être perçue chez l’homme.
Nous avons donc découvert un mécanisme important de la régulation de gènes cardiaques, et plus particulièrement de la régulation du gradient de repolarisation cardiaque. Cette découverte est essentielle pour comprendre comment ces gradients sont formés et bien sûr pour commencer à savoir comment, dans un cœur malade, cette régulation est interrompue, conduisant ainsi à des arythmies parfois mortelles.