| |
| Med Sci (Paris). 2006 February; 22(2): 201–205. Published online 2006 February 15. doi: 10.1051/medsci/2006222201.Rêve et schizophrénie : Un même support neurobiologique ? Claude Gottesmann* Département des Sciences de la Vie, Faculté des Sciences, Université de Nice-Sophia Antipolis, 06108 Nice Cedex 2, France |
Philosophes, écrivains et psychiatres ont de tout temps établi un parallèle entre rêve et folie.
L’électrophysiologie, la tomographie, la pharmacologie et la neurochimie confortent aujourd’hui cette hypothèse.
Les phénomènes psychiques ont longtemps été le domaine réservé des seules sciences humaines, avant que la psychochirurgie, sur des bases expérimentales contestables, puis la psychopharmacologie et la neuropharmacologie ne posent les fondements du fonctionnement cérébral normal et pathologique, ouvrant un large champ d’investigation à l’étude des maladies mentales. Cependant, la connaissance intime des neurotransmetteurs impliqués dans l’élaboration de l’activité mentale reste loin d’être acquise. L’intérêt porté à présent par les neurosciences aux fondements neurochimiques de tel ou tel état de conscience devrait être déterminant pour la compréhension de cette entité complexe que constitue la psychogenèse chez le sujet sain et le malade mental. Le comportement veille-sommeil constitue un bon modèle expérimental pour y parvenir, et plus particulièrement l’étude de l’éveil, dont la nature rationnelle peut être opposée à l’activité onirique du sommeil paradoxal, fantasque, désordonnée, et à bien des égards proche des symptômes de la schizophrénie. Nombreux sont ceux qui ont souligné la troublante parenté entre mode de penser du rêve et folie, tel Schopenhauer qui écrivait que « les rêves sont une courte folie et la folie un long rêve ». Les mécanismes fondamentaux régissant l’éveil et le sommeil sont dépendants de structures sous-corticales. En revanche, c’est principalement le cortex cérébral, structure noble du système nerveux central, qui commande, avec l’appoint de structures adjacentes, aux phénomènes neurophysiologiques sous-tendant la psychogenèse. C’est donc au fonctionnement du cortex que s’attache d’abord toute recherche centrée sur l’activité mentale, puis à celui du noyau accumbens, structure du système limbique particulièrement impliquée dans l’activité hallucinatoire et délirante de la schizophrénie. |
Le cycle veille-sommeil comporte trois phases principales qui vont de l’éveil au sommeil paradoxal en passant par le sommeil lent. Éveil L’éveil est le produit de l’action conjuguée de processus activateurs et inhibiteurs, à la fois antagonistes et complémentaires. On sait, depuis les années 1950, que l’activité électrophysiologique corticale globale (EEG), rapide et de bas voltage recueillie pendant l’éveil, correspond - comme le rythme synchronisé gamma centré sur 40 Hz [
1] - à une forte excitation des neurones corticaux, traduite par la multiplication des potentiels d’action [
2]. Accrue au niveau du cortex, la circulation sanguine, mise en évidence par la tomographie à émission de positons [
3], participe également à cette dynamique de l’éveil. L’acétylcholine, neurotransmetteur essentiellement issu du noyau sous-cortical basilaire (noyau de Meynert chez l’homme) est, avec le glutamate, le principal support de ces processus activateurs qui tous prennent leur source dans le tronc cérébral. Son action, essentiellement excitatrice, s’exerce sur les récepteurs muscariniques des neurones corticaux en diminuant les courants K+ et en bloquant l’hyperpolarisation tardive Ca2+ dépendante qui suit le potentiel d’action. Ces processus activateurs sont cruciaux : leur disparition entraîne le coma. Des influences inhibitrices s’exercent également sur le cortex pendant l’éveil par le biais des terminaisons axonales de neurones monoaminergiques situés dans le tronc cérébral. Ces neurones sont principalement noradrénergiques et sérotoninergiques [
4,
5]. Ils agissent soit directement par augmentation des courants K+ ou blocage des canaux Ca2+, soit indirectement, en activant des interneurones inhibiteurs. Ces neuromodulateurs, qui augmentent le rapport signal/bruit de l’information sensorielle [
6], confèrent aux neurones corticaux, de comportement spontanément anarchique, le mode de décharge régulier qui est celui de l’éveil. De manière paradoxale, ces influences inhibitrices qui culminent dans l’éveil [
7,
8] augmentent donc les capacités fonctionnelles des neurones. L’activité mentale de l’éveil est ainsi tributaire de ces deux types de médiateurs chimiques. Activateurs, ils sous-tendent le fonctionnement cortical ; inhibiteurs, ils canaliseraient les processus activateurs et joueraient un rôle d’ordonnateur du fonctionnement psychique. On peut citer, à l’appui de cette théorie, le lien de cause à effet qui existe entre la baisse des influences inhibitrices noradrénergiques et/ou sérotoninergiques et la survenue des troubles psychologiques de la dépression nerveuse. Sommeil lent Le sommeil lent est constitué d’ondes lentes et de fuseaux corticaux. Il occupe les premiers stades du sommeil. Au cours des phases I, II, III, IV, les décharges neuronales diminuent progressivement [ 2], l’activité gamma se raréfie [ 1] et la circulation sanguine du cortex décroît [ 3]. Cette baisse globale de l’activité corticale est concomitante d’une moindre libération d’acétylcholine [
9]. L’activité des neurones noradrénergiques et sérotoninergiques connaît également un ralentissement [7, 8]. Seuls, les neurones dopaminergiques voient leur activité globalement inchangée [
10]. Sur le plan psychologique, Foulkes [
11] a montré que le système nerveux n’est jamais silencieux. Il recueille, durant cette phase de sommeil, des « pseudo-pensées » proches de la réalité diurne. Il mentionne également certains « rêves », bien que les données actuelles montrent que le rêve vrai ne peut survenir que sur les bases physiologiques du sommeil paradoxal, même si certains de ses critères électrophysiologiques demeurent masqués [
12]. L’activité mentale du sommeil lent est donc le fruit d’influences activatrices et inhibitrices affaiblies, ce qui explique peut-être le contenu psychologique assez pauvre de cette phase de sommeil. Sommeil paradoxal Le sommeil paradoxal a d’abord été identifié par des mouvements oculaires rapides (à l’origine de son appellation anglaise : rapid eye movement-REM-sleep) et un EEG de bas voltage. L’atonie posturale est le propre de cet état de sommeil chez l’animal et l’homme. Les points communs sont légion entre éveil et sommeil paradoxal : EEG, nombre de potentiels d’action, même activité gamma avec cette différence que ce rythme se désorganise dans les aires corticales pendant le sommeil paradoxal où il apparaît découplé [
13], comme le témoin d’une perte de coordination intracérébrale qui a sûrement partie liée avec l’incohérence du contenu onirique. C’est à un dérèglement de même nature que se rattache la discordance psychique de la schizophrénie [
14]. Par ailleurs, l’étude de l’excitabilité cérébrale au cours de l’éveil chez le sujet normal montre qu’une double stimulation sensorielle délivrée à bref intervalle entraîne une forte inhibition de l’onde N100 du second potentiel évoqué. Cette inhibition est absente chez le schizophrène et, contre toute attente, chez le sujet sain pendant le sommeil paradoxal, l’un et l’autre étant associés dans la même anomalie neurologique [
15]. En sommeil paradoxal, la circulation sanguine cérébrale est également comparable, voire supérieure à celle de l’éveil dans le système limbique, siège des réactions émotionnelles, accréditant l’idée de Freud que « c’est bien plus par son fond affectif que par son contenu représentatif que le rêve s’impose à nous comme expérience psychologique ». En revanche, la circulation sanguine chute pendant le rêve dans le cortex préfrontal dorsolatéral [3], ramenée alors au niveau de celle du schizophrène pendant l’éveil [
16], avec pour effet dans l’un et l’autre cas, une même diminution du sens critique. Le cortex visuel primaire est pareillement désactivé pendant le sommeil paradoxal [
17], entraînant une déconnexion sensorielle renforcée par l’inhibition présynaptique des afférences thalamiques [
18]. Cela expliquerait la quasi impossibilité pour les messages périphériques d’accéder au cortex, mettant ainsi « l’esprit à l’abri des distractions, dans un cabinet de travail où le téléphone des sens a été coupé » [
19]. Selon des données récentes, cette baisse des contraintes sensorielles favoriserait l’activité hallucinatoire schizophrénique [
20]. Sur le plan neurochimique, on retrouve en sommeil paradoxal comme dans la veille, une même complémentarité psychophysiologique : libération d’acétylcholine et riche activité mentale. Mais, à la différence de la veille, le silence des neurones inhibiteurs est total en sommeil paradoxal [7, 8]. Notons que cette désinhibition avait déjà été mise en évidence par Evarts [2] avec l’approche électrophysiologique. Observant que les neurones pyramidaux du cortex déchargent - à la différence de l’éveil - par bouffées intenses séparées par des silences prolongés pendant le sommeil paradoxal, cet auteur en concluait à la disparition d’un mécanisme régulateur impliquant des processus inhibiteurs. Demetrescu et al. [
21] avaient montré de même, par un paradigme complexe de potentiels évoqués, que le cortex est soumis à un double flux d’influences excitatrices et inhibitrices, élevé dans l’éveil, diminuant conjointement pendant le sommeil lent, mais réduit aux seules influences excitatrices pendant le sommeil paradoxal. L’intérêt de ces travaux pour la compréhension des mécanismes régissant le mode de penser de l’éveil et du sommeil, pris en compte dès 1967 [
22], est aujourd’hui pleinement confirmé par la neurochimie. |
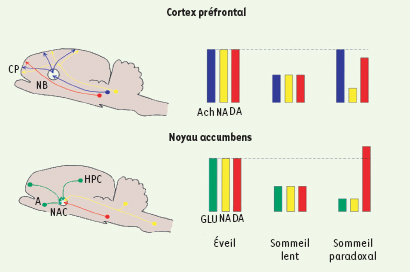
Neurochimie cérébrale et psychogenèse Pendant l’éveil et le sommeil paradoxal, les variables électrophysiologiques circulatoires et neurochimiques concourent à l’activation du cortex, lequel est donc en mesure de générer une activité mentale dans l’un et l’autre état comportemental. L’acétylcholine est le principal moteur de cette vitalité corticale. Elle cohabite, pendant l’éveil, avec les neuromodulateurs inhibiteurs noradrénergiques et sérotoninergiques, de sorte que des influences activatrices et inhibitrices, antagonistes et complémentaires, coopèrent pour engendrer l’activité mentale rationnelle qui est celle de l’individu normal. Pendant le sommeil paradoxal, l’extinction des processus inhibiteurs qui normalisent l’éveil est quasi totale (Figure 1) ; l’activation corticale est seule présente. Le duo activation-inhibition garant de l’équilibre mental étant rompu, un garde-fou semble être tombé, laissant libre champ à l’activité onirique faite d’incohérences, d’associations d’idées irrationnelles et de rêves à répétition qui sont la résurgence de situations à forte charge affective vécues par le passé. C’est à la rupture de ce statu quo physiologique que l’on peut également attribuer la difficulté, l’impossibilité même pour beaucoup de se remémorer un rêve. En effet, on a montré chez l’animal que, dans les secondes qui précèdent le réveil, les mécanismes inhibiteurs entrent à nouveau en action [7]. Si ce même processus d’inhibition joue chez l’Homme, comme on peut le supposer, il constituerait une « censure » neurobiologique s’opposant à l’enregistrement dans le système mnésique de contenus psychiques ne répondant pas aux normes de la veille. On pense à la comparaison de Freud entre l’effacement du rêve et celui du « bloc-note magique ». Lorsque Gérard de Nerval, sombrant dans la folie, parle d’« un épanchement du songe dans la vie réelle » (Aurélia), c’est sans doute à une défaillance de ce mécanisme qu’il faut penser.  | Figure 1.
Neurochimie du comportement veille-sommeil. Dans le cortex cérébral, la concentration extracellulaire d’acétylcholine (Ach, en bleu) est maximale pendant l’éveil et le sommeil paradoxal. Ce neurotransmetteur, principalement issu du noyau basilaire, est lui-même activé par les neurones cholinergiques mésopontiques du tronc cérébral. La noradrénaline (NA, en jaune), libérée par les neurones du locus cœruleus pontique, est maximale pendant l’éveil et minimale pendant le sommeil paradoxal. Dans le cortex préfrontal, la dopamine (DA, en rouge) provenant des neurones de l’aire tegmentale ventrale du mésencéphale est à un taux significativement inférieur en sommeil paradoxal par rapport à l’éveil. Dans le noyau accumbens, le glutamate (GLU, en vert) libéré par le cortex préfrontal et l’hippocampe, mais aussi par l’amygdale, est très diminué en sommeil paradoxal, tout comme la noradrénaline libérée conjointement par des neurones du locus cœruleus et du bulbe rachidien. La libération de dopamine est légèrement plus élevée en sommeil paradoxal qu’en éveil. NB : noyau basilaire ; CP : cortex préfrontal ; A : amygdale basolatérale ; NAC : noyau accumbens ; HPC : hippocampe. |
Sur cette désinhibition quasi complète du cortex pendant le sommeil paradoxal se greffe un autre phénomène, la libération de dopamine, qui contribue certainement au caractère étrange du contenu onirique. Les caractéristiques du rêve : « hallucinations sensori-motrices, imagerie bizarre… diminution du sens critique, instabilité temporo-spatiale… intensification de l’émotion et des comportements instinctifs » [
23], évoquent immanquablement les symptômes de la schizophrénie. Dès 1999 [
24], nous avions vu tout l’intérêt qu’il y avait à réactiver des travaux oubliés montrant que la seule monoamine qui se maintient pendant le sommeil paradoxal est la dopamine [10] dont le dysfonctionnement est avéré dans les psychoses, en particulier dans la schizophrénie. Chez le sujet « normal », lorsque le niveau de dopamine augmente dans l’environnement extracellulaire, sous l’action par exemple d’amphétamines, des rêves vivaces et des cauchemars surviennent ainsi que des troubles de type psychotique. À l’inverse, chez le schizophrène, lorsque l’action de la dopamine est réduite par l’administration de neuroleptiques, hallucinations, délire et rêves disparaissent [
25]. Il semble donc que la dopamine soit une clé de voûte de l’activité mentale et le point commun troublant du rêve et de la schizophrénie. C’est à un excès de dopamine dans le noyau accumbens que l’on attribue généralement les symptômes « positifs » de la schizophrénie (hallucinations, délire, imagerie bizarre), fortement présents dans le rêve. Nos recherches ont montré que la libération de dopamine est maximale dans cette structure pendant le sommeil paradoxal, minimale pendant le sommeil lent, et intermédiaire pendant l’éveil [
26] (Figure 1). Outre le rôle des influences cholinergiques mésopontiques excitatrices agissant sur l’aire tegmentale ventrale [
27], cet accroissement de dopamine pendant le sommeil onirique pourrait être dû à la désactivation du cortex préfrontal [
28] et/ou lié à l’extinction locale des décharges noradrénergiques, compte tenu du rôle facilitateur des antagonistes des récepteurs post-synaptiques β et des agonistes des autorécepteurs présynaptiques α2 [
29]. On a montré, de même, une libération et un turn-over accrus de dopamine dans le noyau accumbens chez les animaux transgéniques dépourvus de récepteurs sérotoninergiques 5-HT1B, [
30]. De plus, à la suite d’une levée d’inhibition exercée par les neurones sérotoninergiques sur les corps cellulaires et les terminaisons limbiques des neurones dopaminergiques, ces derniers pourraient décharger en bouffées plus « généreuses » en neurotransmetteur que ne l’est le mode d’émission régulier [
31]. Le silence sérotoninergique, comme la facilitation cholinergique, pourraient donc contribuer à l’accroissement de la dopamine pendant le sommeil paradoxal : selon Miller et al. [10], la décharge des neurones dopaminergiques y est plus « variable » (c’est-à-dire plus riche en bouffées) qu’en sommeil lent. Il est à noter qu’un même déficit en noradrénaline [
32] et/ou sérotonine [
33] est constaté dans la schizophrénie. Nos travaux ont montré également que la libération de dopamine dans le cortex préfrontal, fortement déprimée en sommeil lent et maximale pendant l’éveil, se trouve à un niveau intermédiaire en sommeil paradoxal [26], sans doute, comme dans la schizophrénie, en deçà des limites étroites de son fonctionnement optimal [
34] (Figure 1). Elle engendrerait dès lors un déficit cognitif, en particulier la diminution du sens critique observée tant dans le rêve [23] que dans cette maladie mentale [34]. Pendant le sommeil onirique, les variations de la dopamine : augmentation dans le noyau accumbens [
35] et diminution dans le cortex préfrontal [34], engendreraient donc des manifestations de type schizophrénique : d’un côté hallucinations, délire, imagerie bizarre, de l’autre affaiblissement du jugement. Le glutamate est également partie prenante dans l’activité onirique et les troubles de la schizophrénie. Le blocage des récepteurs N-méthyl-D-aspartate (NMDA) engendre rêves vivaces [
36] et symptômes psychotiques [
37]. Cette carence dans le noyau accumbens pourrait être d’origine préfrontale et/ou hippocampique [37] ou encore partiellement résulter d’un déficit du glutamate issu des terminaisons dopaminergiques [
38]. Il s’ensuit une exagération des processus émotionnels due aux influences de l’amygdale basolatérale exercées sur le noyau accumbens [37]. Or, en sommeil paradoxal l’amygdale est pareillement très activée [3]. Nos résultats neurochimiques montrant une baisse significative du glutamate dans le noyau accumbens en sommeil lent et sommeil paradoxal [26] sont compatibles avec ces données cliniques (Figure 1). |
Au dysfonctionnement de la dopamine et du glutamate, fauteurs des troubles pseudo-psychotiques du rêve, on trouve nécessairement liée la désinhibition noradrénergique et/ou sérotoninergique. Sachant que les agonistes de ces deux neuromodulateurs sont des adjuvants efficaces des neuroleptiques en clinique et dans les modèles animaux de la schizophrénie [32, 33], faut-il en conclure que l’équation désinhibition-dopamine-glutamate s’impose à l’identique dans le rêve et la schizophrénie ? En dépit du caractère nécessairement plurifactoriel du fonctionnement cérébral, monoamines et glutamate apparaissent actuellement comme la clé de voûte de l’activité mentale et le point commun troublant du rêve et de la schizophrénie. Les mêmes structures cérébrales et les mêmes supports neurochimiques paraissent étayer l’activité mentale qu’elle soit rêve ou délire. Le neuropsychiatre Henri Ey ne disait-il pas : « Il est évident, il ne peut pas ne pas être évident que rêve et folie jaillissent des mêmes sources ». Il s’agit à n’en pas douter d’une double similitude neurobiologique et psychologique [
39] : les représentations fantasmatiques de la création onirique sont sœurs de l’imagerie hallucinatoire de Maupassant, des vertiges picturaux de Vincent Van Gogh et du « la » obsédant qui persécutait le compositeur Robert Schumann. |
Je remercie vivement Marc Rodi pour l’iconographie.
|
Footnotes |
1. Llinas R, Ribary U. Coherent 40 Hz oscillation characterizes dream state in humans. Proc Nat Acad Sci USA 1993; 90 : 2078–81. 2. Evarts EV. Temporal patterns of discharge of pyramidal tract neurons during sleep and waking in the monkey. J Neurophysiol 1964; 27 : 152–71. 3. Maquet P. Functional neuroimaging of normal sleep by positon emission tomography. J Sleep Res 2000; 9 : 207–31. 4. Araneda R, Andrade R. 5-Hydroxytryptamine 2 and 5-hydroxytryptamine 1A receptors mediate opposing responses on membrane excitability in the association cortex. Neuroscience 1991; 40 : 399–412. 5. Manunta Y, Edeline JM. Effects of noradrenaline on frequency tuning of auditory cortex neurons during wakefulness and slow wave sleep. Eur J Neurosci 1999; 11 : 2134–50. 6. Aston-Jones G, Bloom FE. Norepinephrine-containing locus coeruleus neurons in behaving rat exhibit pronounced responses to non-noxious environmental stimuli. J Neurosci 1981; 1 : 887–900. 7. Aston-Jones G, Bloom FE. Activity of norepinephrine-containing neurons in behaving rats anticipates fluctuations in the sleep-waking cycle. J Neurosci 1981; 1 : 876–86. 8. McGinty DJ, Harper RM. Dorsal raphe neurons : depression of firing during sleep in cats. Brain Res 1976; 101 : 569–75. 9. Marrosu F, Portas C, Mascia MF, et al. Microdialysis measurement of cortical and hippocampal acetylcholine release during sleep-wake cycle in freely moving cats. Brain Res 1995; 671 : 329–32. 10. Miller JD, Farber J, Gatz P, et al. Activity of mesencephalic dopamine and non-dopamine neurons across stages of sleep and waking in the rat. Brain Res 1983; 273 : 133–41. 11. Foulkes WD. Dream reports from different stages of sleep. J Abnorm Soc Psychol 1962; 65 : 14–25. 12. Takeuchi T, Miyasita A, Inugami M, Yamamoto Y. Intrinsic dreams are not produced without REM sleep mechanims : evidence through elicitation of sleep onset periods. J Sleep Res 2001; 10 : 43–52. 13. Perez-Garci E, del Rio-Portilla Y, Guevara MA, et al. Paradoxical sleep is characterized by uncoupled gamma activity between frontal and perceptual cortical regions. Sleep 2001; 24 : 118–26. 14. Meyer-Lindenberg A, Poline JB, Kohn PD, et al. Evidence for abnormal cortical functional connectivity during working memory in schizophrenia. Am J Psychiatr 2001; 158 : 1809–17. 15. Kisley MA, Olincy A, Robbins E, et al. Sensory gating impairement associated with schizophrenia persists into REM sleep. Psychophysiology 2003; 40 : 29–38. 16. Weinberger DR, Berman KF, Zec RF. Physiological dysfunction of dorsolateral prefrontal cortex in schizophrenia. 1. Regional cerebral blood flow evidence. Arch Gen Psychiatr 1986; 43 : 114–24. 17. Braun AR, Balkin TJ, Wesensten NJ, et al. Dissociated pattern of activity in visual cortices and their projections during human rapid eye movement sleep. Science 1998; 279 : 91–5. 18. Gandolfo G, Arnaud, C, Gottesmann C. Transmission in the ventrobasal complex of rat during the sleep-waking cycle. Brain Res Bull 1980; 5 : 921–7. 19. Pommier J. Le langage intérieur. Paris : Denoël, 1970 : 128 p. 20. Behrendt RP, Young C. Hallucinations in schizophrenia, sensori impairment and brain disease : an unified model. Behav Brain Sci 2004; 27 : 771–87. 21. Demetrescu M, Demetrescu M, Iosif G. Diffuse regulation of visual thalamo-cortical responsiveness during sleep and wakefulness. Electroenceph Clin Neurophysiol 1966; 20 : 450–69. 22. Gottesmann C. Recherche sur la psychophysiologie du sommeil chez le rat. Paris : Presses du Palais Royal, 1967 : 156 p. 23. Hobson JA, Stickgold R, Pace-Schott EF. The neuropsychology of REM sleep dreaming. NeuroReport 1998; 9 : R1–14. 24. Gottesmann C. Neurophysiological support of consciousness during waking and sleep. Prog Neurobiol 1999; 59 : 469–508. 25. Solms M. Dreaming and REM sleep are controlled by different brain mechanisms. Behav Brain Sci 2000; 23 : 843–50. 26. Léna I, Parrot S, Deschaux O, et al. Variations in the extracellular levels of dopamine, noradrenaline, glutamate and aspartate across the sleep-wake cycle in the medial prefrontal cortex and nucleus accumbens of freely moving rats. J Neurosci Res 2005; 81 : 891–9. 27. Miller AD, Blaha CD. Midbrain muscarinic receptor mechanisms underlying regulation of mesoaccumbens and nigrostriatal dopaminergic transmission in the rat. Eur J Neurosci 2005; 21 : 1837–46. 28. Brake WG, Flores G, Francis D, et al. Enhanced nucleus accumbens dopamine and plasma corticosterone stress responses in adult rats with neonatal excitotoxic lesions to the medial prefrontal cortex. Neuroscience 2000; 96 : 687–95. 29. Hertel P, Fagerquist MV, Svensson TH. Enhanced cortical dopamine output and antipsychotic-like effects of raclopride by α2 adrenoceptor blockade. Science 2001; 286 : 105–9. 30. Shippenberg TS, Hen R, He M. Region-specific enhancement of basal extracellular and cocaine-evoked dopamine levels following constitutive deletion of the serotonin (B1) receptor. J Neurochem 2000; 75 : 258–65. 31. Chergui K, Suaud-Chagny MF, Gonon F. Non-linear relationship between impulse flow. Dopamine release and dopamine elimination in the rat in vivo. Neuroscience1994; 62 : 641–5. 32. Linner L, Wiker C, Wadenberg ML, et al. Noradrenaline reuptake inhibition enhances the antipsychotic-like effect of raclopride and potentiates D2-blockade-induced dopamine release in the medial prefrontal cortex of the rat. Neuropsychopharmacology 2002; 27 : 691–8. 33. Silver H, Barash I, Aharon N, et al. Fluvoxamine augmentation of antipsychotics improves negative symptoms in psychotic chronic schizophrenic patients : a placebo-controlled study. Int Clin Psychopharmacol 2000; 15 : 257–61. 34. Abi-Dargham A, Moore H. Prefrontal DA transmission at D1 receptors and the pathology of schizophrenia. Neuroscientist 2003; 9 : 404–16. 35. MacKay AV, Iversen LL, Rossor M, et al. Increased brain dopamine and dopamine receptors in schizophrenia. Arch Gen Psychiatr 1982; 39 : 991–7. 36. Reeves M, Lindholm DE, Myles PS, et al. Adding ketamine to morphine for patient-controlled analgesia after major abdominal surgery : a double-blind, randomized trial. Anesth Analg 2001; 93 : 116–20. 37. Grace AA. Gating information flow within the limbic system and the pathophysiology of schizophrenia. Brain Res Rev 2000; 31 : 330–41. 38. Chuhma N, Zhang H, Masson J, et al. Dopamine neurons mediate a fast excitatory signal via their glutamatergic synapses. J Neurosci2004; 24 : 972–81. 39. Gottesmann C. Dreaming and schizophrenia. A common neurobiological background. Sleep Biol Rhyt 2005; 3 : 64–74. |