| |
| Med Sci (Paris). 2006 February; 22(2): 153–157. Published online 2006 February 15. doi: 10.1051/medsci/2006222153.Peptides antimicrobiens naturels cutanés Jens-Michael Schröder* and Jürgen Harder Clinical research unit, Department of Dermatology, University Hospital Schleswig-Holstein, Campus Kiel, Schittenhelmstrasse 7, D-24105 Kiel, Allemagne |
Peptides et protéines antimicrobiens cutanés en situation non pathologique L’analyse systématique de couche cornée extraite de sujets sains, à la recherche de peptides ou de protéines antimicrobiens (AMP) constitutifs, a permis l’identification du lysozyme, une protéine antimicrobienne exprimée par les kératinocytes [
1,
2]. Mais le principal peptide antimicrobien est la RNase 7, une protéine hautement basique dont la structure est similaire à celle des membres de la superfamille de la RNase A, parmi lesquels on retrouve la RNase 2 (EDN, eosinophil-derived neurotoxin), la RNase 3 (ECP, eosinophil-derived cationic protein) et la RNase 5 (angiogénine) [
3]. La RNase 7, dont la teneur dans la couche cornée saine varie de 4 à 8 mg/g, présente un large spectre d’activité antimicrobienne [3]. Elle tue avec une grande efficacité une souche d’Enterococcus faecium résistance à la vancomycine, et ce dès une concentration de 20 nM : d’un point de vue molaire, la RNase 7 est donc la plus puissante et la plus efficace des protéines antimicrobiennes humaines connues aujourd’hui. Elle est exprimée par les kératinocytes de la peau humaine et de divers autres tissus épithéliaux [3], et son expression peut être induite par des cytokines pro-inflammatoires ou par des bactéries ; le mécanisme moléculaire par lequel ces dernières déclenchent la production de RNase 7 par les kératinocytes reste toutefois inconnu. L’efficacité de la RNase 7 à tuer des entérocoques à des concentrations de l’ordre du nanomolaire suggère qu’elle pourrait jouer un rôle de protection de la peau vis-à-vis des bactéries intestinales à Gram+. De fait, il est rare que des bactéries intestinales colonisent les surfaces cutanées ; de plus, certaines bactéries y meurent rapidement, tandis que d’autres y survivent [
4]. La peau humaine saine semble ainsi capable de produire, de façon constitutive, une arme contre E. coli, mais pas contre S. aureus (Figure 1) [
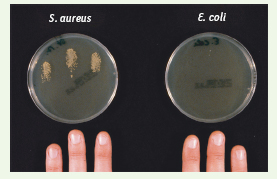
5] : cette arme est la psoriasine, une protéine de la famille des protéines S 100 (S100-A7). 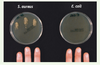 | Figure 1.
Survie de S. aureus ou E. coli à la surface de la peau. Les extrémités des doigts, lavés, d’un volontaire sain sont inoculées artificiellement avec une souche de S. aureus ou d’ E. coli. Après exposition pendant 30 minutes, les extrémités des doigts sont appliquées sur un gel d’agar, et les colonies de S. aureus (à gauche) ou E. coli (à droite) dénombrées (d’après [ 5]). E. coli n’est pas transféré, suggérant que la peau humaine produit de façon constitutive une défense chimique capable de tuer les souches d’ E. coli. |
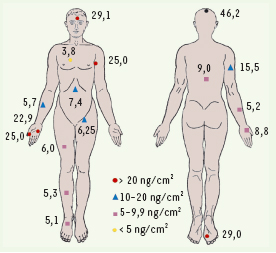
La psoriasine est notamment produite dans les zones où la colonisation bactérienne est abondante (Figure 2), ainsi que dans les glandes sébacées, ce qui suggère qu’elle pourrait être co-sécrétée avec les lipides. L’extraction par l’acétone de zones cutanées riches en lipides aboutit effectivement à l’obtention d’une grande quantité de psoriasine, qui semble donc également stockée dans la couche lipidique de la peau saine. La psoriasine, qui possède une activité antimicrobienne essentiellement dirigée contre E. coli, avec une LD50 (dose entraînant la destruction de 50 % des souches) proche de 0,5 µM, est probablement le principal composant bactéricide de la peau : le traitement de volontaires sains par un anticorps neutralisant la psoriasine entraîne d’ailleurs une augmentation de la croissance d’E. coli. 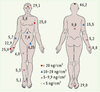 | Figure 2.
Concentrations locales de psoriasine en différents sites de l’organisme humain sain. Des zones standardisées situées en différents points de l’organisme de volontaires sains ont été lavées avec un tampon de phosphate de Na (10 mM, pH 7,4), et leur concentration en psoriasine déterminée (d’après [ 5]). |
Les glandes sudoripares eccrines produisent quant à elles un peptide antimicrobien, la dermcidine, produite et exprimée de façon constitutive sous la forme d’un précurseur se transformant en peptide actif dans la sueur, après protéolyse [
6]. |
hBD-2, premier peptide antimicrobien épithélial inductible identifié chez l’homme La β-défensine 2 humaine (hBD-2), un peptide de 4 kDa se liant à l’héparine [
7], représente l’un des principaux peptides antimicrobiens contenus dans les extraits squameux provenant de lésions psoriasiques (pour revue, voir [
8]). Inactive face à S. aureus, hBD-2 possède une activité antimicrobienne essentiellement dirigée contre diverses bactéries à Gram- ; cette activité est toutefois inhibée par une concentration en NaCl de 150 mM [
9], et donc probablement absente dans le sérum ou sur les surfaces cutanées recouvertes de sueur évaporée. Le peptide hBD-2 est notamment exprimé par certaines cellules différenciées de la peau inflammatoire [
10], ce qui suggère qu’elle est induite localement, et qu’un état de différenciation et d’inflammation suffisant est nécessaire à cette induction [
11]. Dans les cellules épithéliales, les interleukines (IL) 1α et 1β, de même qu’une souche vivante de Pseudomonas aeruginosa, sont les inducteurs les plus puissants, compatibles avec ce qui pourrait être observé in vivo, de la production d’hBD-2 [11–
14]. Les mécanismes utilisés par les bactéries pour induire la production d’hBD-2 reste toutefois non élucidés ; bien que le CD14 et les récepteurs Toll-like (TLR) aient été proposés comme mécanismes importants dans le système de reconnaissance, il existe aujourd’hui une controverse quant à l’implication directe des TLR dans l’induction d’hBD-2 in vivo. En cas d’inflammation, cependant, il est probable que l’induction d’hBD-2 intervienne principalement via la signalisation par l’IL 1 dérivée des phagocytes mononucléaires [
13]. Les bactéries peuvent également stimuler directement la production épithéliale d’hBD-2, comme cela a été montré, pour diverses bactéries, dans des cellules épithéliales de la bouche [
15,
16]. Dans une étude portant sur des cellules épithéliales issues du tractus respiratoire, seul un isolat clinique de P. aeruginosa, de phénotype mucoïde, était capable d’induire la production d’hBD-2 [9]. Ces résultats suggèrent que, hormis les ligands activateurs de TLR, d’autres molécules encore inconnues peuvent induire la production d’hBD-2, probablement même en l’absence d’inflammation. |
hBD-3, un peptide antimicrobien inductible au large spectre La défensine-β 3 humaine (hBD-3), un peptide de 5 kDa hautement basique (pI 10,08) initialement découvert dans des extraits squameux de lésions psoriasiques [
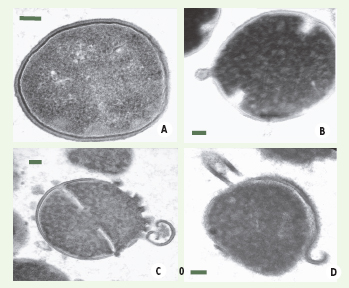
17], présente une activité antimicrobienne à large spectre, puissante et sensible au NaCl, et dirigée contre beaucoup de bactéries à Gram+ ou à Gram- et de champignons, certaines de ces souches étant résistantes. Le mécanisme par lequel hBD-3 tue S. aureus est, là encore, inconnu. L’analyse ultrastructurale de S. aureus soumis à l’action d’hBD-3 révèle des modifications morphologiques similaires à celles observées quand la bactérie est mise en présence de pénicilline (Figure 3) [17]. 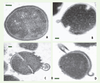 | Figure 3.
Modifications morphologiques observées sur
S. aureus
traité par hBD-3. Analyse par microscopie électronique à transmission d’une souche de S. aureus incubée pendant 2 heures en tampon phosphate 10 mM (A) ou traitée par le peptide synthétique hBD-3 pendant 30 minutes (B) ou 2 heures (C et D). Des signes de perforation de la paroi cellulaire sont visibles, avec une libération quasi-explosive de la membrane plasmique dès 30 minutes d’incubation (B). Au bout de 2 heures ( C et D), la plupart des cellules subissent une bactériolyse et une désintégration à différents degrés. Ces effets ressemblent à ceux observés lorsqu’une souche de S. aureus est traitée avec de la pénicilline [
28], un antibiotique qui interfère avec la réticulation des peptidoglycanes de la paroi cellulaire bactérienne. Les barres correspondent à 0,1 μm (d’après [ 17]). |
L’ARN messager de hBD-3 est exprimé dans les épithélium de divers organes, ainsi que dans certains tissus non épithéliaux [17]. Bien que le petide soit une β-défensine inductible, son expression est régulée différemment de celle d’hBD-2. Dans les kératinocytes, hBD-3 est modérément induite par le TNFα, et plus puissamment par l’interféron γ [
18]. L’IGF-I (insulin-like growth factor) et le TGFβ (transforming growth factor) induisent également la synthèse d’hBD-3, par un mécanisme de transactivation (relargage du TGFα par un processus dépendant d’une métalloprotéase) du récepteur de l’EGF (epidermal growth factor) [13]. |
La cathélicidine humaine hCAP-18/LL-37 Les cathélicidines sont des molécules contenant un domaine cathelin (cathepsin L inhibitor) à leur extrémité aminoterminale et, à leur extrémité carboxyterminale, un domaine hautement cationique, α-hélicoïdal, portant une activité antimicrobienne. Un seul gène codant pour une cathélicidine a pu être retrouvé chez l’homme [
19]. Son produit, hCAP-18 (human cathelicidin antimicrobial protein), est une des protéines majeures des granules secondaires des polynucléaires neutrophiles, dans lesquels elle est stockée sous forme d’un précurseur qui subira, dans un second temps, une protéolyse par la protéinase 3 pour donner naissance à son peptide carboxyterminal, le LL-37. Bien que les neutrophiles constituent la source cellulaire majeure d’hCAP-18, cette protéine est également exprimée dans la peau et dans d’autres tissus épithéliaux (pour revue, voir [
20]) ; non exprimée dans la peau saine, hCAP-18 est induite dans les kératinocytes localisés dans les zones inflammatoires au cours de divers troubles cutanés inflammatoires [
21], où elle est stockée dans les granules lamellaires cutanés [
22]. Cette induction de l’expression d’hCAP-18 par les kératinocytes impliquent l’intervention de l’IGF-I, ainsi que celle du TGFα ou de la 1,25-dihydroxyvitamine D3 [
23].
In vitro, hCAP-18 inhibe, à des concentrations de l’ordre du mM, la croissance de diverses bactéries à Gram- ou à Gram+. Quant à l’implication des cathélicidines in vivo, elle a été démontrée dans un modèle murin : les souris n’exprimant plus la protéine Cramp (cathelicidin-related antimicrobial peptide, homologue murin de LL37) sont plus suceptibles que les souris sauvages aux infections cutanées causées par des streptocoques du groupe A [
24]. |
Rôle des peptides antimicrobiens dans les maladies cutanées Dans l’hypothèse où les peptides antimicrobiens naturels sont d’importants effecteurs de la « barrière chimique » mise en place pour protéger la peau des infections comme de l’inflammation, il est logique de spéculer que des déficiences dans ce système de protection pourraient conduire à la survenue d’infections locales récurrentes. Inversement, on peut supposer qu’une surexpression de ces peptides, comme c’est le cas au cours du psoriasis [8], surprotège contre les infections cutanées : de fait, les infections cutanées chez les patients atteints de psoriasis sont rares [
25]. À l’opposé, les patients atteints d’eczéma atopique, chez qui une diminution de l’expression d’hBD-2 et -3 et de LL37 est observée dans les lésions aiguës et chroniques, souffrent souvent d’infections causées par S. aureus [
26,
27]. Il est possible que l’augmentation de l’expression des peptides antimicrobiens, normalement attendue dans des lésions inflammatoires atopiques, soit en réalité inhibée par les concentrations élevées de cytokines de type Th2, susceptibles d’inhiber l’induction d’hBD-2 et -3. |
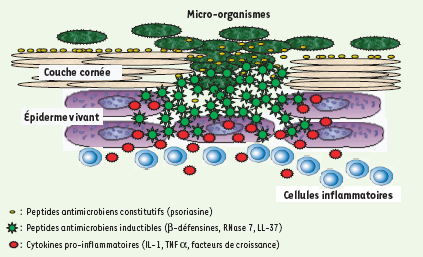
Conclusions et perspectives La défense naturelle de la peau semble donc être, chez l’homme sain, en partie assurée par une « barrière chimique », composée de peptides et de protéines antimicrobiens (AMP) exprimés dans l’épiderme, soit de façon constitutive dans les zones les plus superficielles, et stockés dans la couche cornée, soit de façon inductible, dans la partie plus profonde, vivante, de l’épiderme (Figure 4). 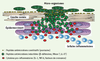 | Figure 4.
Organisation de la « barrière chimique » cutanée. Les bactéries résidant à la surface de la peau sont prises en charge par des peptides antimicrobiens constitutifs (notamment par la psoriasine). Lorsque la barrière physique est détruite, les bactéries ou leurs dérivés induisent la production de cytokines pro-inflammatoires ou de peptides (ou protéines) antimicrobiens par les kératinocytes (et les leucocytes infiltrés). |
La découverte que la psoriasine, qui est bactéricide en entraînant une déprivation en zinc, est la principale protéine cutanée antimicrobienne chez l’homme [5] suggère que des déprivations en oligo-éléments essentiels pourraient servir de fondement à de nouvelles stratégies visant à contrôler la croissance microbienne sur les surfaces cutanées (hors zones de désquamation). L’expression localisée de différents AMP dans la peau saine, dénuée de tout signe visible d’inflammation, conduit également à supposer qu’il existe des situations où la production d’AMP est induite en l’absence de cytokines pro-inflammatoires ou de facteurs de croissance produits durant la cicatrisation, et que des micro-organismes présents sur les surfaces cutanées pourraient faciliter l’induction d’AMP en l’absence de toute inflammation. Des composants de ces bactéries, capables d’initier la production épithéliale d’AMP, pourraient alors être utilisés pour augmenter la résistance cutanée aux infections. |
Footnotes |
1. Elias PM. Stratum corneum defensive functions: an integrated view. J Invest Dermatol 2005; 125 : 183–200. 2. Ogawa H, Miyazaki H, Kimura M. Isolation and characterization of human skin lysozyme. J Invest Dermatol 1971; 57 : 111–6. 3. Harder J, Schröder JM. RNase 7, a novel innate immune defense antimicrobial protein of healthy human skin. J Biol Chem 2002; 277 : 46779–84. 4. Casewell MW, Desai N. Survival of multiply-resistant Klebsiella aerogenes and other gram negative bacilli on finger-tips. J Hosp Infect 1983; 4 : 350–60. 5. Gläser R, Harder J, Lange H, et al. Antimicrobial psoriasin (S100A7) protects human skin from Escherichia coli infection. Nat Immunol 2005; 6 : 57–64. 6. Schittek B, Hipfel R, Sauer B, et al. Dermcidin: a novel human antibiotic peptide secreted by sweat glands. Nat Immunol 2001; 2 : 1133–7. 7. Harder J, Bartels J, Christophers E, et al. A peptide antibiotic from human skin. Nature 1997; 387 : 861 8. Harder J, Schröder JM. Psoriatic scales: a promising source for the isolation of human skin-derived antimicrobial proteins. J Leukoc Biol 2005; 77 : 476–86 9. Harder J, Meyer-Hoffert U, Teran LM, et al. Mucoid Pseudomonas aeruginosa, TNF-alpha, and IL-1beta, but not IL-6, induce human beta-defensin-2 in respiratory epithelia. Am J Respir Cell Mol Biol 2000; 22 : 714–21 10. Ali RS, Falconer A, Ikram M, et al. Expression of the peptide antibiotics human beta defensin-1 and human beta defensin-2 in normal human skin. J Invest Dermatol 2001; 117 : 106–11. 11. Harder J, Meyer-Hoffert U, Wehkamp K, et al. Differential gene induction of human beta-defensins (hBD-1, -2, -3, and -4) in keratinocytes is inhibited by retinoic acid. J Invest Dermatol 2004; 123 : 522–9. 12. Becker MN, Diamond G, Verghese MW, et al. CD14-dependent lipopolysaccharide-induced beta-defensin-2 expression in human tracheobronchial epithelium. J Biol Chem 2000; 275: 29731–36. 13. Sörensen OE, Thapa DR, Rosenthal A, et al. Differential regulation of b-defensin expression in human skin by microbial stimuli. J Immunol 2005; 174 : 4870–9. 14. Liu L, Roberts AA, Ganz T. By IL-1 signaling, monocyte-derived cells dramatically enhance the epidermal antimicrobial response to lipopolysaccharide. J Immunol 2003; 170 : 575–80. 15. Krisanaprakornkit S, Kimball JR, Weinberg A, et al. Inducible expression of human beta-defensin 2 by Fusobacterium nucleatum in oral epithelial cells: multiple signaling pathways and role of commensal bacteria in innate immunity and the epithelial barrier. Infect Immun 2000; 68 : 2907–15. 16. Chung WO, Dale BA. Innate immune response of oral and foreskin keratinocytes: utilization of different signaling pathways by various bacterial species. Infect Immun 2004; 72 : 352–8. 17. Harder J, Bartels J, Christophers E, et al. Isolation and characterization of human beta -defensin-3, a novel human inducible peptide antibiotic. J Biol Chem 2001; 276 : 5707–13. 18. Garcia JR, Jaumann F, Schulz S, et al. Identification of a novel, multifunctional beta-defensin (human beta-defensin 3) with specific antimicrobial activity. Its interaction with plasma membranes of Xenopus oocytes and the induction of macrophage chemoattraction. Cell Tissue Res 2001; 306 : 257–64. 19. Agerberth B, Gunne H, Odeberg J, et al. FALL-39, a putative human peptide antibiotic, is cysteine-free and expressed in bone marrow and testis. Proc Natl Acad Sci USA 1995; 92 : 195–9. 20. Zanetti M. The role of cathelicidins in the innate host defenses of mammals. Curr Issues Mol Biol 2005; 7 : 179–96. 21. Frohm M, Agerberth B, Ahangari G, et al. The expression of the gene coding for the antibacterial peptide LL-37 is induced in human keratinocytes during inflammatory disorders. J Biol Chem 1997; 272 : 15258–63. 22. Murakami M, Ohtake T, Dorschner RA, et al. Cathelicidin anti-microbial peptide expression in sweat, an innate defense system for the skin. J Invest Dermatol 2002; 119 : 1090–5. 23. Gombart AF, Borregaard N, Koeffler HP. Human cathelicidin antimicrobial peptide (CAMP) gene is a direct target of the vitamin D receptor and is strongly up-regulated in myeloid cells by 1,25-dihydroxyvitamin D3. FASEB J 2005; 19 : 1067–77. 24. Nizet V, Ohtake T, Lauth X, et al. Innate antimicrobial peptide protects the skin from invasive bacterial infection. Nature 2001; 414 : 454–7. 25. Henseler T, Christophers E. Disease concomitance in psoriasis. J Am Acad Dermatol 1995; 32 : 982–6 26. Nomura I, Goleva E, Howell MD, et al. Cytokine milieu of atopic dermatitis, as compared to psoriasis, skin prevents induction of innate immune response genes. J Immunol 2003; 171 : 3262–9. 27. Ong PY, Ohtake T, Brandt C, et al. Endogenous antimicrobial peptides and skin infections in atopic dermatitis. N Engl J Med 2002; 347 : 1151–60. 28. Giesbrecht P, Kersten T, Maidhof H, Wecke J. Staphylococcal cell wall: morphogenesis and fatal variations in the presence of penicillin. Microbiol Mol Biol Rev 1998; 62 : 1371–1414. |