| |
| Med Sci (Paris). 2006 January; 22(1): 87–94. Published online 2006 January 15. doi: 10.1051/medsci/200622187.La découverte de l’ivabradine (Procoralan®), inhibiteur sélectif du courant pacemaker
I
f : Une nouvelle approche thérapeutique des cardiopathies ischémiques Jean-paul Vilaine* Institut de Recherches Servier, Division Pathologies cardiaques et vasculaires, 11, rue des Moulineaux, 92150 Suresnes, France |
Les cardiopathies ischémiques représentent toujours, à l’heure actuelle, une cause majeure de morbidité et de mortalité et pèsent lourdement sur la santé publique des pays industrialisés. Le vieillissement de la population dans la plupart de ces pays laisse prévoir une augmentation continue de la prévalence globale de cette pathologie et de son évolution vers l’insuffisance cardiaque. Malgré le recours de plus en plus fréquent aux techniques de revascularisation myocardique, en particulier percutanées, le traitement médical, tant à visée symptomatique que préventive, reste toujours aussi indispensable pour la majorité des patients. Une étude chez des patients ayant subi une revascularisation percutanée a montré une prévalence combinée de l’angor et des événements coronaires de plus de 18 % [
1] et la nécessité d’un traitement anti-angineux chez plus de 60 % des patients. Par ailleurs, une revascularisation myocardique n’est pas toujours indiquée, même en cas de symptomatologie sévère [
2]. Si l’utilité du traitement médical conventionnel anti-ischémique (β-bloquants, inhibiteurs calciques, dérivés nitrés) n’est plus à démontrer, il connaît pourtant des limites. Celles-ci concernent les angors réfractaires, l’existence d’une insuffisance cardiaque [
3], les effets secondaires (affectant la compliance au traitement), la sécurité d’emploi, les contre-indications et une prévention insuffisante vis-à-vis de la mortalité et des évènements coronaires majeurs, d’ailleurs seulement démontrée avec les β-bloquants dans le post-infarctus [
4–
6]. C’est dans ce contexte que le concept d’une nouvelle molécule, l’ivabradine (Procoralan®), capable de réduire de façon sélective la fréquence cardiaque, apparaît comme particulièrement prometteur. |
Fréquence cardiaque et cardiopathies ischémiques La fréquence cardiaque est le facteur hémodynamique le plus important de la consommation d’O2 myocardique [
7,
8]. La durée de la diastole joue un rôle d’autant plus critique pour la perfusion myocardique que la réserve de vasodilatation coronaire en aval d’une sténose est limitée. L’accélération de la fréquence cardiaque contribue au déclenchement ou à l’aggravation de la plupart des épisodes d’ischémie myocardique en augmentant la consommation d’O2 et en réduisant le temps de perfusion myocardiques, voire en induisant une vasoconstriction coronaire aggravant les conséquences hémodynamiques d’une sténose athéromateuse, comme cela a été montré chez des patients coronariens soumis à une stimulation auriculaire rapide [
9]. De plus, la tachycardie est le facteur le plus délétère d’une stimulation sympathique sur le cœur ischémique [
10]. Inversement, on peut attendre une puissante activité anti-ischémique d’une réduction sélective de la fréquence cardiaque, capable de diminuer la consommation d’O2 myocardique, d’augmenter le temps de perfusion diastolique et de prévenir la survenue d’une vasoconstriction coronaire dépendante de la fréquence. La réduction de la fréquence cardiaque apparaît d’ailleurs essentielle à l’activité anti-ischémique des β-bloquants [
11]. De surcroît, l’augmentation chronique de la fréquence cardiaque est un facteur prédictif de mortalité chez les coronariens comme dans la population générale [
12–
18]. Inversement, la réduction de la mortalité observée dans les cardiopathies ischémiques ou l’insuffisance cardiaque avec les β-bloquants, certains inhibiteurs calciques et l’amiodarone, est attribuée au ralentissement de la fréquence cardiaque qu’ils entraînent [
19–
23]. Différents mécanismes ont été invoqués pour expliquer le lien entre la fréquence cardiaque et la mortalité des cardiopathies ischémiques : relation inverse entre niveau de fréquence cardiaque et seuil de fibrillation ventriculaire [
24,
25], rôle aggravant d’une augmentation chronique de la fréquence cardiaque sur le développement des lésions d’athérosclérose chez l’animal [
26–
28] comme chez l’homme [
29,
30], implication dans le déclenchement des ruptures des plaques d’athérosclérose coronaires par les modifications hémodynamiques liées à la tachycardie [
31]. Enfin, la réduction de la fréquence cardiaque peut faciliter le développement d’une angiogenèse coronaire chez l’animal [
32–
34], ainsi que celui d’une circulation collatérale coronaire chez l’homme [
35] qui joue un rôle majeur sur le pronostic. |
Courant pacemaker I
f et réduction sélective de la fréquence cardiaque Le mécanisme fondamental à l’origine de l’activité électrique spontanée des cellules pacemakers du nœud sinusal cardiaque est la dépolarisation diastolique spontanée qui amène le potentiel de membrane de sa valeur maximale, en fin de repolarisation d’un potentiel d’action, jusqu’à la valeur seuil déclenchant un nouveau potentiel d’action. Cette activité spontanée, transmise ensuite à l’ensemble du cœur par le tissu de conduction, subit l’influence du système nerveux autonome. Le courant I
f est le courant majeur impliqué dans la dépolarisation spontanée diastolique des cellules pacemaker et est régulé de façon directe par l’AMPc [
36–
38]. Une stimulation β-adrénergique, en augmentant la concentration en AMPc intracellulaire, augmente le courant I
f et la pente de dépolarisation diastolique, ce qui diminue le temps de diastole et accélère la fréquence cardiaque. Une stimulation vagale induit des effets opposés et ralentit la fréquence cardiaque en augmentant le temps de diastole. L’inhibition directe du courant I
f est donc une cible idéale pour réduire de façon sélective tant la fréquence de repos que son accélération, notamment lors d’une augmentation du tonus sympathique. Ces données ont conduit l’Institut de Recherches Servier à identifier un produit capable de réduire de façon sélective la fréquence cardiaque, via l’inhibition du courant pacemaker I
f, et donc dénué des effets hémodynamiques potentiellement délétères des β-bloquants (effet inotrope négatif et démasquage d’une vasoconstriction coronaire d’origine α-adrénergique [
39,
40]) ou des inhibiteurs calciques (effet inotrope négatif et/ou vasodilatateur). Les objectifs étaient : (1) d’exercer un puissant effet anti-ischémique dans les cardiopathies ischémiques, qu’elles soient aiguës ou chroniques, avec ou sans insuffisance cardiaque aiguë ou chronique ; (2) d’améliorer le pronostic à long terme des cardiopathies ischémiques par les effets bénéfiques attribués à la réduction chronique de la fréquence cardiaque. |
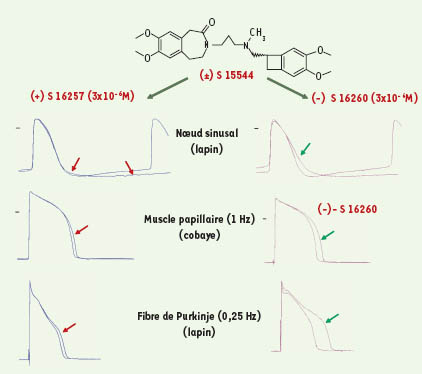
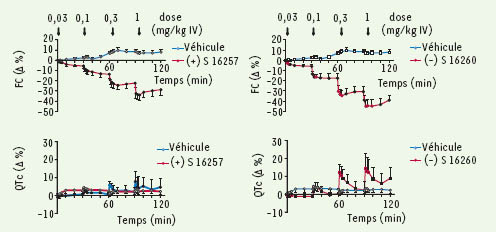
Sélection de l’ivabradine (Procoralan ®) Le criblage d’une série de composés benzocycloalkanes a montré que les dérivés benzocyclobutanes ou indanes étaient les plus à même de réduire, à faibles concentrations (µM), la fréquence de l’activité spontanée d’oreillettes droites isolées de rat, de diminuer la pente de dépolarisation diastolique lente du potentiel d’action de préparations sino-auriculaires de lapin et de réduire la fréquence cardiaque de rats vigiles. Les composés indanes, allongeant de façon importante la durée de potentiels d’action de préparations ventriculaires, furent écartés en raison du risque potentiel d’induction de torsades de pointe. Le composé racémique benzocyclobutane, S 15544, fut retenu en raison de ses effets très inférieurs sur la durée du potentiel d’action de muscle papillaire de cobaye par rapport à ceux des dérivés indanes. Ses deux isomères, S 16257, isomère (+) de configuration absolue S, et son inverse optique (-), S 16260, furent séparés pour analyser leur activité pharmacologique [
41]. L’étude électrophysiologique in vitro a montré l’équipotence de ces isomères pour réduire l’activité électrique spontanée de préparations sino-auriculaires de lapin, mais une meilleure sélectivité électrophysiologique du S 16257, qui induisait des effets minimes sur la durée du potentiel d’action de préparations de muscle papillaire de cobaye et de fibre de Purkinje de lapin, contrairement au S 16260 (Figure 1). Ces données ont été confirmées in vivo chez le porc anesthésié (Figure 2), montrant l’équipotence des deux isomères à réduire la fréquence cardiaque, et l’absence d’effet du S 16257 sur l’intervalle QT de l’électrocardiogramme, corrigé de la fréquence cardiaque (QTc), contrairement au S 16260 qui allongeait de façon dose-dépendante le QTc, témoignant d’un effet direct sur la repolarisation ventriculaire.  | Figure 1.
Effets du S 16257 et du S 16260 [isomères optiques du (±) S 15544] sur le potentiel d’action d’une préparation sino-auriculaire de lapin, d’un muscle papillaire de cobaye et d’une fibre de Purkinje de lapin. Les flèches indiquent l’évolution des potentiels d’action après 30 minutes d’incubation d’une concentration de 3310 -6 M des produits (modifiée à partir de [
43]). |
 | Figure 2.
Comparaison des effets du S 16257 et du S 16260 sur la fréquence cardiaque (FC) et l’espace QTc (espace QT corrigé de la fréquence cardiaque) après administration par voie IV, de doses cumulées de 0,03 à 1 mg/kg, chez le porc anesthésié. Les données représentent les moyennes ± ESM (n = 10 par groupe). |
Cette différence majeure, laissant prévoir une sécurité d’emploi insuffisante pour le S 16260, ou pour le composé racémique S 15544 le contenant, a conduit à privilégier l’étude du S 16257 pour la suite de l’exploration préclinique. Ce produit sélectionné pour le développement clinique est devenu l’ivabradine (Procoralan®) dont la formule est : [3-(3-{[((7S)-3,4-dimethoxybicyclo[4,2,0]octa-1,3,5-trien-7-yl) methyl]methylamino}propyl) -1,3,4,5-tetrahydro-7,8-dimethoxy-2H-3-benzazepin-2-one]. |
Caractéristiques pharmacologiques de l’ivabradine (Procoralan ®) Études in vitro
Réduction directe et sélective de l’activité pacemaker cardiaque
-
Oreillette droite isolée de rat
L’ivabradine ralentit la fréquence des battements spontanés d’oreillettes droites isolées de rat, de façon dépendante de la concentration et très progressive. Le maximum d’effet observé trois heures après application de concentrations uniques de produit, allant de 5,6310- 8 à 5,6310- 7 M, a permis le calcul d’une IC30 (concentration réduisant de 30 % la fréquence initiale) à 1,9 10- 7 M, très inférieure à celle calculée dans un protocole de criblage initial utilisant des concentrations cumulatives appliquées toutes les 30 minutes (2,1310- 6 M). Cet effet ne dépend pas d’une stimulation des récepteurs muscariniques car il n’est pas modifié en présence d’atropine (10- 7 M). L’ivabradine n’inhibe pas les récepteurs β-adrénergiques. En effet, l’ivabradine (3310- 6 M) réduit la fréquence de base des préparations et limite leur accélération induite par des concentrations croissantes d’isoprénaline (10- 9 à 5,5310- 8 M) sans en modifier l’EC50 (concentration induisant 50 % de l’effet maximum) contrairement à un β-bloquant. Ces données ont été confirmées par des études de liaison qui ont montré l’absence d’affinité de l’ivabradine pour les récepteurs muscariniques et β-adrénergiques . Études électrophysiologiques sur préparations multicellulaires cardiaques
-
Nœud sinusal de lapin
L’ivabradine ralentit, de façon concentration-dépendante, l’activité électrique spontanée de préparations sino-auriculaires de lapin, entraînant une réduction de la fréquence de déclenchement spontané des potentiels d’action de 23,8 % ± 3.9 %, 40 minutes après l’application d’une concentration de 3310 - 6 M [
42]. Cet effet dépend entièrement d’une réduction de la pente de dépolarisation diastolique, sans modification du potentiel maximal diastolique ni du potentiel seuil à partir duquel se déclenche les potentiels d’action. L’ivabradine ne modifie pas l’amplitude du potentiel d’action et n’induit qu’un effet minime sur sa durée [ 42, 43].
-
Préparations ventriculaires entraînées à fréquence constante
Sur des muscles papillaires de cobaye stimulés à 1 Hz, des concentrations croissantes d’ivabradine induisent un discret allongement de la durée du potentiel d’action (Figure 1), maximum à 3310- 6 M (+9,0 % ± 0,9 % à 90 % de repolarisation), sans modification de ses autres paramètres [42]. Sur des fibres de Purkinje de lapin, très sensibles aux produits qui augmentent la durée du potentiel d’action, d’autant plus qu’elles sont entraînées à fréquence très lente (0,25 Hz), l’ivabradine (3310- 6 M), n’induit qu’une faible augmentation de la durée de repolarisation (Figure 1). L’absence d’effet de concentrations micromolaires d’ivabradine sur la phase de plateau du potentiel d’action de ces deux préparations et sur la tension développée par les muscles papillaires, mesurée parallèlement à leur activité électrique, tout comme son absence d’effet inotrope négatif sur des oreillettes gauches de rat, isolées et stimulées, et d’effet relaxant sur des aortes de rat contractées par le KCl (80 mM), permettent de conclure à son absence d’effet inhibiteur calcique.
Inhibition sélective du courant I
f
L’effet d’ivabradine a été évalué en patch clamp sur les différents courants ioniques impliqués dans l’activité pacemaker du nœud sinusal [
44].
-
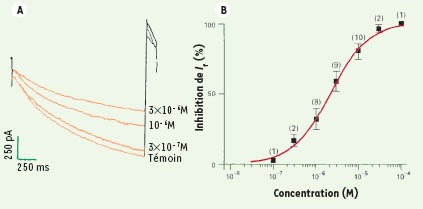
Courant I
f
Le courant I
f, a été enregistré en patch clamp sur des cellules de nœud sinusal de lapin en configuration de cellule entière. L’ivabradine inhibe le courant I
f de façon « utilisation-dépendante » sans en modifier la courbe d’activation en fonction du potentiel. Cet effet est concentration-dépendant (Figure 3), avec une IC 50 à 2,2310 - 6 M [
45].  | Figure 3.
Inhibition concentration-dépendante du courant I
f
de cellules isolées de nœud sinusal de lapin. A. Tracés de courant I
f témoin et inhibé par des concentrations croissantes d’ivabradine. B. Courbe d’inhibition concentration-dépendante de I
f (IC 50 = 2.2310 - 6 M) (modifiée à partir de [ 45]). |
-
Courants ICa,T, ICa, L et IKr
L’ivabradine, à la forte concentration de 10 - 5 M, ne modifie pas le courant calcique de type T ( I
Ca, T), induit une diminution de 18,1 % ± 0,7 % du courant calcique de type L ( I
Ca, L). Aucun effet n’est observé sur le courant potassique I
Kr à la concentration de 3310 - 6 M, alors qu’une diminution de 16,3 % ± 1,2 % est induite à 10 - 5 M. L’ivabradine inhibe donc le courant pacemaker I
f de façon sélective aux concentrations micromolaires [ 45].
Études in vivo
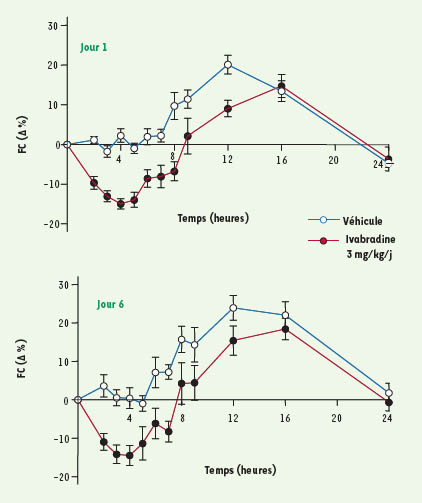
Réduction de la fréquence cardiaque chez le rat vigile L’administration unique de l’ivabradine par voie orale chez des rats Wistar induit une réduction dose-dépendante de la fréquence cardiaque sans modification de la pression artérielle moyenne. L’effet maximal, qui se maintient au moins six heures, est respectivement de − 14,1 % ± 3,0 % et − 22,0 % ± 4,7 % aux doses de 1,5 et 6 mg/kg. L’administration répétée d’ivabradine (3 mg/kg) par voie orale, une fois par jour pendant six jours, a été étudiée chez le rat Wistar dont la fréquence cardiaque et la pression artérielle ont été suivis par télémétrie. Dès J1, l’ivabradine réduit la fréquence cardiaque de façon significative au bout de deux heures par rapport au groupe témoin (véhicule = eau distillée) et maximale après quatre heures (− 15,0 % ± 1,3 %). Cet effet, limitant la tachycardie nocturne de ces animaux, reste significatif 12 heures après administration par rapport au groupe témoin (Figure 4). Cette activité reste inchangée après six jours de traitement et ne s’accompagne pas de modification de la pression artérielle moyenne.  | Figure 4.
Réduction de la fréquence cardiaque (FC) après administration répétée par voie orale d’ivabradine (3 mg/kg/jour) chez des rats vigiles pendant six jours. Les données représentent les variations en pourcentage à partir des valeurs avant traitement et sont exprimées en moyennes ± ESM (n = 12 par groupe). |
Étude hémodynamique chez le porc anesthésié Chez le porc Large-White anesthésié, l’ivabradine, administrée par voie IV en doses cumulées (0,03, 0,1, 0,3 et 1 mg/kg) toutes les 30 minutes, réduit la fréquence cardiaque de façon significative par rapport aux témoins et dose-dépendante (de − 15,7 % ± 3,0 % à − 36,8 % ± 4,1 % aux doses de 0,1 mg/kg et 1 mg/kg, respectivement). Cet effet maximal se maintient pendant les 30 minutes d’observation après chaque dose. L’ivabradine n’induit à aucune des doses, par rapport au groupe témoin, de modification significative de la pression artérielle moyenne ou de la contractilité myocardique ni d’allongement significatif de l’intervalle PR ou de l’espace QTc (Figure 2) [ 43]. La consommation d’O2 myocardique est réduite de façon dose-dépendante (de - 11,7 % ± 4,7 % et - 31,6 % ± 6,9 % aux doses de 0,1 mg/kg et 1 mg/kg, respectivement) sans modification du rapport apport d’O2 sur consommation d’O2, prouvant l’absence d’effet direct sur le tonus vasomoteur coronaire. Effets hémodynamiques systémiques et coronaires chez le chien au repos et à l’exercice Les effets hémodynamiques sur la circulation coronaire de l’ivabradine (0,5 mg/kg IV) et du propranolol (1 mg/kg IV) ont été comparés chez le chien au repos et à l’exercice [
46]. Tous deux réduisent de façon comparable la fréquence cardiaque de repos et la tachycardie d’effort. Le propranolol diminue la contractilité de repos et limite sévèrement son augmentation lors de l’exercice, alors que l’ivabradine ne modifie pas la contractilité au repos et la faible réduction de son augmentation à l’exercice est liée à la réduction de la fréquence cardiaque, puisqu’elle disparaît lorsque la fréquence cardiaque est maintenue constante par stimulation auriculaire. Le propranolol réduit la vasodilatation coronaire normale induite par l’exercice et provoque une diminution du diamètre coronaire artériel contrairement à l’augmentation de diamètre observée lors d’un exercice contrôle. Ces effets persistent sous stimulation auriculaire et peuvent être attribués à un démasquage du tonus vasoconstricteur α-adrénergique en présence du blocage β-adrénergique [ 39– 40]. L’ivabradine, au contraire, respecte la vasodilatation coronaire induite par l’exercice et préserve une augmentation du diamètre coronaire dont l’atténuation par rapport à un exercice témoin est liée à l’effet sur la fréquence cardiaque. Enfin, l’ivabradine ne modifie pas l’augmentation du débit cardiaque et du volume d’éjection systolique induite par l’exercice, alors que le propranolol les réduit. Effet anti-ischémique chez le porc à l’exercice Les effets de l’ivabradine et du propranolol ont été comparés sur un modèle d’ischémie myocardique régionale, induite par l’exercice sur tapis roulant, chez le micro-porc Yucatan porteur d’une sténose fixe de l’artère coronaire interventriculaire antérieure [
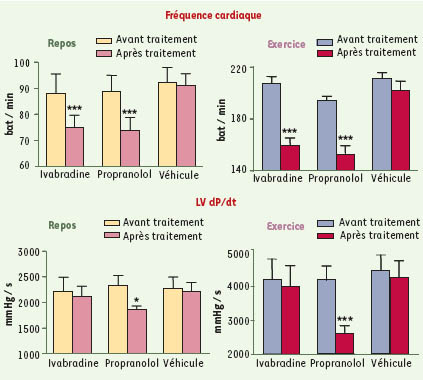
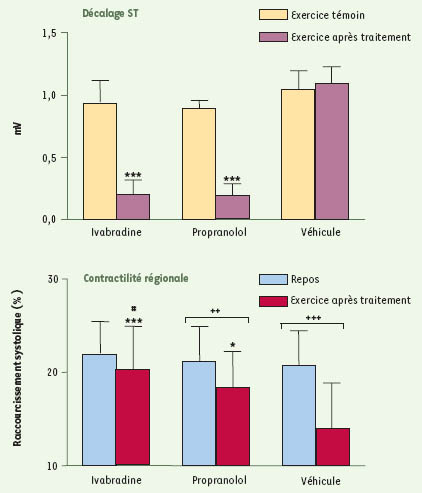
47]. Le degré d’ischémie myocardique a été évalué par le décalage du segment ST d’électrocardiogrammes locaux et le dysfonctionnement contractile myocardique, mesurés à l’aide de cristaux à ultrasons implantés dans le myocarde post-sténotique. Dans ce modèle, l’ivabradine et le propranolol réduisent de façon comparable la fréquence cardiaque au repos et à l’exercice (Figure 5), sans modifier la pression artérielle moyenne. Contrairement à l’ivabradine, le propranolol diminue de façon significative la contractilité myocardique globale (LVdP/dt) au repos et à l’exercice. Si, lors de l’exercice, les deux produits réduisent de façon significative et comparable (≈80 %) le décalage du segment ST dans la zone irriguée par l’artère coronaire sténosée, l’ivabradine préserve de façon significativement supérieure au propranolol la contractilité myocardique régionale (Figure 6). L’ivabradine prévient en effet totalement la diminution de la contractilité myocardique de la zone ischémique, observée lors des exercices témoins et après traitement par véhicule, contrairement au propranolol qui laisse persister un dysfonctionnement contractile significatif, bien que réduit par rapport aux exercices après traitement par véhicule.  | Figure 5.
Modèle d’ischémie myocardique induite par l’exercice chez le porc. Comparaison des effets de l’ivabradine (5 mg/kg, par voie orale), du propranolol (5 mg/kg, par voie orale) et de leur véhicule sur la fréquence cardiaque et la LVdP/dt au repos et lors d’un exercice réalisé trois heures après traitements. Les données sont exprimées en moyennes ± ESM (n = 5). L’analyse statistique a été réalisée à l’aide d’une analyse de variance à deux facteurs (traitement/période) avec mesures répétées sur les deux facteurs, suivie par un test de Newman-Keuls. *p < 0,05, ***p < 0,001 : significativité versus véhicule (modifiée à partir de [ 47]). |
 | Figure 6.
Modèle d’ischémie myocardique induite par l’exercice chez le porc. Comparaison des effets d’ivabradine (5 mg/kg, par voie orale), du propranolol (5 mg/kg, par voie orale) et de leur véhicule sur le décalage du segment ST et la contractilité régionale du myocarde post-sténotique lors d’un exercice réalisé 3 heures après traitements. Les données sont exprimées en moyennes ± ESM (n = 5). L’analyse statistique a été réalisée à l’aide d’une analyse de variance à deux facteurs (traitement 3 période) avec mesures répétées sur les deux facteurs, suivie par un test de Newman-Keuls. *p < 0,05, ***p < 0,001 : significativité versus exercice après traitement avec véhicule ; #p < 0,05 : significativité versus exercice après traitement avec propranolol ; ++p < 0,01, +++p < 0,001 : significativité entre les valeurs au repos et pendant l’exercice [ 47]. |
|
Les propriétés décrites pour l’ivabradine lors des études précliniques ont été confirmées chez l’homme, notamment : (1) sa sélectivité électrophysiologique qui, par inhibition du courant I
f du nœud sinusal, permet de réduire la fréquence cardiaque sans modifier la conduction auriculo-ventriculaire et la repolarisation ventriculaire [
48] ; (2) sa sélectivité hémodynamique permettant le maintien de la fraction d’éjection chez des patients présentant un dysfonctionnement ventriculaire gauche [
49] ; (3) son activité de prévention de l’ischémie myocardique induite par l’exercice chez des patients présentant un angor stable [
50], d’un niveau comparable à celui d’un β-bloquant [
51]. Au-delà de la prévention de l’ischémie d’effort, démontrée dans l’angor stable, le bénéfice de l’ivabradine est attendu dans les formes aiguës d’ischémie myocardique (angor instable, infarctus du myocarde) et dans le post-infarctus, tout particulièrement en présence d’une insuffisance cardiaque aiguë ou chronique, comme le suggère des résultats dans un modèle d’insuffisance cardiaque d’origine ischémique chez le rat [
52]. Par ailleurs, le courant I
f, normalement seulement détectable au niveau du tissu nodal, peut être exprimé au niveau de cellules ventriculaires de cœurs en insuffisance cardiaque [
53] où il pourrait représenter un mécanisme arythmogène dont l’inhibition par ivabradine pourrait être bénéfique. Enfin, le défi majeur pour l’ivabradine est de démontrer, par les grands essais cliniques en cours, sa capacité à améliorer le pronostic des cardiopathies ischémiques en réduisant la mortalité et la survenue d’événements cardiovasculaires majeurs, en prévenant l’ischémie myocardique, en limitant la progression et les complications de l’athérosclérose, en renforçant le développement de la circulation coronaire collatérale, en améliorant le remodelage cardiaque et en inhibant certains mécanismes arythmogènes. |
Footnotes |
1. Holubkov R, Laskey WK, Haviland A, et al. Angina 1 year after percutaneous coronary intervention : a report from the NHLBI Dynamic Registry. Am Heart J 2002; 144 : 826–33. 2. Mannheimer C, Camici P, Chester MR, et al. The problem of chronic refractory angina ; report from the ESC Joint Study Group on the Treatment of Refractory Angina. Eur Heart J 2002; 23 : 355–70. 3. Steg PG, Dabbous OH, Feldman LJ, et al. Determinants and pronostic impact of heart failure complicating acute coronary syndromes : observations from the Global Registry of Acute Coronary Events (GRACE). Circulation 2004; 109 : 494–9. 4. Freemantle N, Cleland J, Young P, et al. β blockade after myocardial infarction : systematic review and meta regression analysis. Br Med J 1999; 318 : 1730–7. 5. Dargie HJ, Colucci W, Ford I, et al. Effect of carvedilol on outcome after myocardial infarction in patients with left ventricular dysfunction : the CAPRICORN randomised trial Lancet 2001; 357 : 1385–90. 6. Janosi A, Ghali JK, Herlitz J, et al. Metoprolol CR/XL in postmyocardial infarction patients with chronic heart failure : Experiences from MERIT-HF. Am Heart J 2003; 146 : 721–8. 7. Sonnenblick EH, Ross J Jr, Braunwald E. Oxygen consumption of the heart. Newer concepts of its multifactorial determination. Am J Cardiol 1968; 22 : 328–36. 8. Vatner SF, Higgings CB, Franklin D, Braunwald E. Role of tachycardia in mediating the coronary hemodynamic response to severe exercice. J Appl Physiol 1972; 32 : 380–5. 9. Nabel EG, Selwyn AP, Ganz P. Paradoxical narrowing of atherosclerotic coronary arteries induced by increases in heart rate. Circulation 1990; 81 : 850–9. 10. Vatner SF, Baig H. Importance of heart rate in determining the effects of sympathomimetic amines on regional myocardial function and blood flow in conscious dogs with acute myocardial ischemia. Circ Res 1979; 45 : 793–803. 11. Guth BD, Heusch G, Steitelberger R, et al. Mechanism of beneficial effect of β-adrenergic blockade on exercise-induced myocardial ischemia in conscious dogs. Circ Res 1987; 60 : 738–46. 12. Dyer AR, Persky V, Stamler J, et al. Heart rate as a prognostic factor for coronary heart disease and mortality : findings in three Chicago epidemiologic studies. Am J Epidemiol 1980; 112 : 736–49. 13. Kannel WB, Kannel C, Paffengarger RS Jr, et al. Heart rate and cardiovascular mortality : the Framingham Study. Am Heart J 1987; 113 : 1489–94. 14. Hjalmarson A, Gilpin EA, Kjekshus JK, et al. Influence of heart rate on mortality after acute myocardial infarction. Am J Cardiol 1990; 65 : 547–53. 15. Greenland P, Daviglus ML, Dyer AR, et al. Resting heart rate is a risk factor for cardiovascular and noncardiovascular mortality : the Chicago Heart Association Detection Project in Industry. Am J Epidemiol 1999; 149 : 853–62. 16. Kristal-Boneh E, Silber H, Harari G, et al. The association of resting heart rate with cardiovascular, cancer and all-cause mortality. Eight year follow-up of 3527 male Israeli employees (the CORDIS Study). Eur Heart J 2000; 21 : 116–24. 17. Aronow WS, Ahn C, Mercando AD, et al. Association of average heart rate on 24-hour ambulatory electrocardiograms with incidence of new coronary events at 48-month follow-up in 1,311 patients (mean age 81 years) with heart disease and sinus rhythm. Am J Cardiol 1996; 78 : 1175–6. 18. Diaz A, Bourassa MG, Guertin MC, et al. Long term prognostic value of resting heart rate in patients with suspected or proven coronary artery disease. Eur Heart J 2005; 26 : 967–74. 19. Kjekshus J. Importance of heart rate in determining beta-blocker efficacy in acute and long-term myocardial infarction intervention trials. Am J Cardiol 1986; 57 : 43F–9. 20. The Multicenter Diltiazem Postinfarction Trial Research Group. Effect of diltiazem on mortality and reinfarction after myocardial infarction. N Engl J Med 1988; 319 : 385–92. 21. Packer M, Bristow MR, Cohn JN, et al. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. N Engl J Med 1996; 334 : 1349–55. 22. CIBIS Investigators and Committees. A randomised trial of β-blockade in heart failure. The Cardiac Insufficiency Bisoprolol Study (CIBIS). Circulation 1994; 90 : 1765–73. 23. Nul DR, Doval HC, Grancelli HO, et al. Heart rate is a marker of amiodarone mortality reduction in severe heart failure. J Am Coll Cardiol 1997; 29 : 1199–205. 24. James R, Arnold J, Allen J, et al. The effects of heart rate, myocardial ischemia and vagal stimulation on the threshold of ventricular fibrillation. Circulation 1977; 55 : 311–7. 25. Bernier M, Curtis JM, Hearse DJ. Ischemia-induced and reperfusion-induced arrhythmias : importance of heart rate. Am J Physiol 1989; 256 : H21–31. 26. Beere PA, Glagov S, Zarins CK. Retarding effect of lowered heart rate on coronary atherosclerosis. Science 1984; 226 : 180–2. 27. Kaplan JR, Manuck SB, Clarkson TB. The influence of heart rate on coronary atherosclerosis. J Cardiovasc Pharmacol 1987; 10 : S100–2. 28. Beere PA, Glagov S, Zarins CK. Experimental atherosclerosis at the carotid bifurcation of the cynomolgus monkey. Localization, compensatory enlargement, and the sparing effect of lowered heart rate. Atheroscler Thromb 1992; 12 : 1245–53. 29. Perski A, Hamsten A, Linvall K, et al. Heart rate correlates with severity of coronary artery atherosclerosis in young postinfarction patients. Am Heart J 1988; 116 : 1369–73. 30. Perski A Ollson G, Landou C, et al. Minimum heart rate and coronary atherosclerosis : Independent relations to global severity and rate of progression of angiographic lesions in men with myocardial infarction at a young age. Am Heart J 1992; 123 : 609–16. 31. Heidland UE, Strauer BE. Left ventricular muscle mass and elevated heart rate are associated with coronary plaque disruption. Circulation 2001; 104 : 1477–82. 32. Wright AJ, Hudlicka O. Capillary growth and changes in heart performance induced by chronic bradycardial pacing in the rabbit. Circ Res 1981; 49 : 469–78. 33. Wright AJ, Hudlicka O, Brown MD. Beneficial effect of chronic bradycardial pacing on capillary growth and heart performance in volume overload heart hypertrophy. Circ Res 1989; 64 : 1205–12. 34. Zheng W, Brown MD, Brock TA, et al. Bradycardia-induced coronary angiogenesis is dependent on vascular endothelial growth factor. Circ Res 1999; 85 : 192–8. 35. Patel SR, Breal JA, Diver DJ, et al. Bradycardia is associated with development of coronary collaterals in humans. Coron Artery Dis 2000; 11 : 467–72. 36. DiFrancesco D. Pacemaker mechanisms in cardiac tissue. Annu Rev Physiol 1993; 55 : 451–67. 37. DiFrancesco D. The onset and autonomic regulation of cardiac pacemaker activity : relevance of the f current. Cardiovac Res 1995; 29 : 449–56. 38. DiFrancesco D, Mangoni M. Modulation of single hyperpolarization-activated channels (If) by cAMP in the rabbit sino-atrial node. J Physiol 1994; 474 : 473–82. 39. Heyndrickx GR, Pannier JL, Muylaert P, et al. Alteration in myocardial oxygen balance during exercise after β-adrenergic blockade in dogs. J Appl Physiol 1980; 49 : 28–33. 40. Berdeaux A, Drieu la Rochelle C, Richard V, et al. Opposed responses of large and small coronary arteries to propranolol during exercise in dogs. Am J Physiol 1991; 261 : H265–70. 41. Peglion JL, Vian J, Thollon C, et al. S 16257, a novel sinoatrial node modulator : potent bradycardic activity with improved specificity. Can J Physiol Pharmacol 1994; 72 (suppl 1) : 95 (abstract). 42. Thollon C, Cambarrat C, Vian J, et al. Electrophysiological effects of S 16257, a novel sino-atrial node modulator, on rabbit and guinea-pig cardiac preparations : comparison with UL-FS 49. Br J Pharmacol 1994; 112 : 37–42. 43. Thollon C, Bibouard JP, Cambarrat C, et al. Stereospecific in vitro and in vivo effects of the new sinus node inhibitor (+)-S 16257. Eur J Pharmacol 1997; 339 : 43–51. 44. Irisawa H, Brown HF, Giles W. Cardiac pacemaking in the sinoatrial node. Physiol Rev 1993; 73 : 197–227. 45. Bois P, Bescond J, Renaudon B, et al. Mode of action of bradycardic agent, S 16257, on ionic currents of rabbit sinoatrial node cells. Br J Pharmacol 1996; 118 : 1051–7. 46. Simon L, Ghaleh B, Puybasset L, et al. Coronary and haemodynamic effects of S 16257, a new bradycardic agent, in resting and exercising conscious dogs. J Pharmacol Exp Ther 1995; 275 : 659–66. 47. Vilaine JP, Bidouard JP, Lesage L, et al. Anti-ischemic effects of ivabradine, a selective heart rate reducing agent, in exercise-induced myocardial ischemia in pigs. J Cardiovasc Pharmacol 2003; 42 : 688–96. 48. Camm AJ, Lau CP. Electrophysiological effects of a single intravenous administration of ivabradine (S 16257) in adult patients with normal baseline electrophysiology. Drugs RD 2003; 4 : 83–9. 49. Manz M, Reuter M, Lauck G, et al. A single intravenous dose of ivabradine, a novel I(f) inhibitor lowers heart rate but does not depress left ventricular in patients with left ventricular dysfunction. Cardiology 2003; 100 : 149–55. 50. Borer JS, Fox K, Jaillon P, et al. Antianginal and antiischemic effects of ivabradine, an If inhibitor, in stable angina. A randomized, double-blind, multicentered, placebo-controlled trial. Circulation 2003; 107 : 817–23. 51. Tardif JC, Ford I, Tendera M, et al. Efficacy of ivabradine, a new selective If
inhibitor, compared with atenolol in patients with chronic stable angina. Eur Heart J 2005; 26 : 2529–36. 52. Mulder P, Barbier S, Chagraoui A, et al. Long-term heart rate reduction induced by the selective I
f current inhibitor ivabradine improves left ventricular function and intrinsic myocardial structure in congestive heart failure. Circulation 2004; 109 : 1674 – 9. 53. Cerbai E, Pino R, Porciatti F, et al. Characterization of the hyperpolarization-activated current, I
f, in ventricular myocytes from human failing heart. Circulation 1997; 95 : 568–71. |