Chez les mammifères, les cellules natural killer (NK) jouent un rôle important dans la réponse immunitaire, dite « innée » [ 1]. Elles ont la capacité de détruire directement par cytotoxicité les cellules altérées par des virus ou par des oncogènes. Elles ont aussi la propriété de produire des facteurs solubles, comme l’interféron γ, qui provoquent le recrutement d’autres cellules immunes telles que les macrophages et les lymphocytes T, contribuant ainsi à l’élimination des cellules anormales. Les cellules NK possèdent de nombreux récepteurs activateurs ou inhibiteurs, qui reconnaissent des ligands présents à la surface des cellules cibles potentielles (Figure 1). Chez l’humain, les récepteurs NK activateurs incluent NKG2D, CD16, les natural cytotoxicity receptors, et les killer activating receptors (KAR) ; pour leur part, les récepteurs inhibiteurs sont surtout représentés par les killer inhibitory receptors (KIR). Les ligands des KIR sont les complexes majeurs d’histocompatibilité (CMH) de classe I, qui sont abondamment exprimés à la surface des cellules saines.
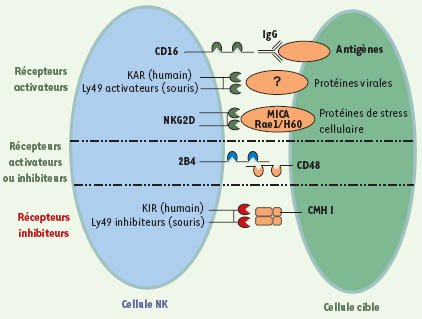
| Figure 1.
Modèle de reconnaissance entre une cellule NK et une cellule cible. Les cellules NK interagissent avec les cellules cibles grâce à différents types de récepteurs. CD16 reconnaît la portion Fc des immunoglobulines G (IgG) liées à des antigènes de surface. CD16 est responsable de l’ADCC (antibody-dependent cellular cytotoxicity). La plupart des killer activating receptors (KAR ; chez l’humain) et les Ly49 activateurs (chez la souris) reconnaissent des ligands inconnus. NKG2D, le plus étudié des récepteurs activateurs, possède comme ligands les protéines de stress comme MICA (MHC class I polypeptide-related sequence A) chez l’humain et les protéines de la famille des Rae-1 chez la souris. L’expression de ces ligands est grandement augmentée dans les cellules cancéreuses ou infectées par des virus. Les killer inhibitory receptors (KIR ; chez l’humain) et les Ly49 inhibiteurs (chez la souris) reconnaissent les complexes majeurs d’histocompatibilité (CMH) de classe I sur les cellules cibles. L’expression des CMH de classe I est diminuée à la surface des cellules transformées ou infectées par des virus. Certains récepteurs comme 2B4, qui reconnaît comme ligand CD48, peuvent être soit activateurs, soit inhibiteurs. |
La résultante nette entre les signaux activateurs et inhibiteurs induits dans une cellule NK détermine si celle-ci va détruire une cellule cible potentielle [1]. Typiquement, les infections virales, la transformation cancéreuse et divers types de stress cellulaire provoquent chez les cellules cibles potentielles une augmentation de l’expression des ligands pour les récepteurs NK activateurs, de même qu’une diminution de l’abondance des ligands pour les récepteurs NK inhibiteurs. Cela permet une élimination expéditive des cellules cibles par les cellules NK. Malheureusement, dans certains cas, les cellules pathologiques ne sont pas reconnues par les cellules NK. Cette situation peut conduire à des infections virales disséminées ou à des cancers métastatiques.
Outre les récepteurs activateurs et inhibiteurs classiques, les cellules NK comptent d’autres récepteurs en particulier 2B4 (ou CD244), un membre de la famille SLAM (signalling lymphocyte activating molecule) qui reconnaît comme ligand CD48, un récepteur présent sur la majorité des cellules hématopoïétiques [ 2, 3] (Figure 1). L’expression de CD48 est fortement augmentée sur les lymphocytes B humains infectés par le virus d’Epstein Barr (EBV), principale cause de la mononucléose infectieuse. Grâce à son domaine intracytoplasmique, 2B4 est associé via des tyrosines phosphorylées à SAP (aussi appelée SH2D1A ou DSHP), une petite molécule intracellulaire composée presque exclusivement d’un domaine Src homology 2 (SH2) [3– 5] (Figure 2). La molécule SAP est inactive chez les humains souffrant du syndrome lymphoprolifératif lié au chromosome X (X-linked lymphoproliferative disease, XLP), maladie caractérisée par une réponse immune inadéquate à l’infection par l’EBV [3–5]. Puisque SAP est essentielle à la fonction activatrice de 2B4 [3– 6], son absence pourrait expliquer la pathogénie du XLP. Deux régions de liaison dans le domaine SH2 de SAP sont importantes pour sa fonction : l’une pour les tyrosines phosphorylées de 2B4 et l’autre centrée sur l’arginine 78 de SAP qui permet le recrutement de la protéine tyrosine kinase FynT [ 7] (Figure 2). FynT est essentielle pour les signaux intracellulaires induits par SAP [7, 8].
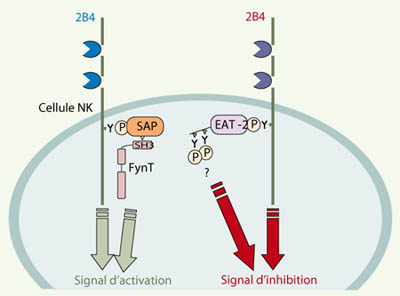
| Figure 2.
Modèle de signalisation intracellulaire par 2B4. L’association de 2B4 à SAP ou à EAT-2 dicte le type de signal intracellulaire produit par 2B4 dans la cellule NK. La présence de l’arginine 78 dans le domaine SH2 de SAP permet le recrutement de FynT, une protéine tyrosine kinase de la famille Src. Cette interaction permet à 2B4 d’induire un signal de phosphorylation sur des résidus tyrosines qui stimule l’activité des cellules NK. EAT-2 ne contient pas l’arginine 78, mais elle possède deux tyrosines dans sa portion carboxy-terminale. Phosphorylées, ces tyrosines permettent de coupler 2B4 à un signal (de nature inconnue) qui inhibe l’activité des cellules NK. |
Ces observations nous ont amenés à étudier le rôle des deux autres membres de la famille SAP, soit EAT-2 et ERT [ 9]. Comme SAP, EAT-2 et ERT s’associent à 2B4 dans les cellules NK (Figure 2). Mais, contrairement à SAP, EAT-2 et ERT ne peuvent pas interagir avec FynT [7], ce qui suggère qu’elles jouent un rôle distinct de celui de SAP. Cette possibilité a été confirmée par la création dans notre laboratoire de souris déficientes en EAT 2 ou ERT [9]. La fonction de plusieurs récepteurs activateurs notamment 2B4, CD16, NKG2D et Ly49D (Ly49D est un équivalent des KAR chez la souris) est fortement augmentée dans les cellules NK déficientes en EAT-2 ou ERT. Les cellules NK eat-2−/− ou ert−/− sont aussi plus efficaces pour tuer les cellules cancéreuses in vitro et in vivo. Donc, contrairement à SAP qui stimule la fonction de 2B4 dans les cellules NK, EAT-2 et ERT inhibent l’activité de 2B4, de même que celle d’autres récepteurs NK activateurs. Cette différence fonctionnelle n’est pas la conséquence d’interactions supplémentaires entre EAT-2 ou ERT et d’autres récepteurs activateurs car, tout comme SAP, EAT-2 et ERT sont associées uniquement à 2B4 dans les cellules NK murines. La fonction inhibitrice d’EAT-2 et ERT est causée par la phosphorylation de deux tyrosines carboxy-terminales qui sont présentes dans ces molécules, mais pas dans SAP (Figure 2). Nous postulons que la phosphorylation de ces tyrosines permet le recrutement d’effecteurs intracellulaires capables d’inhiber la fonction des récepteurs NK activateurs. L’identité de ces effecteurs demeure pour l’instant inconnue. La présence d’EAT-2 dans les cellules dendritiques et les macrophages suggère que cette molécule pourrait avoir un rôle analogue dans ces cellules.
Nos résultats démontrent l’importance de la famille SAP dans la réponse immunitaire normale. Bien qu’ERT n’existe pas chez l’humain, nous avons confirmé la fonction inhibitrice d’EAT-2 dans les cellules NK humaines [9]. Cette conservation de fonction suggère que des inhibiteurs chimiques pourraient être utilisés pour réprimer l’activité d’EAT-2 chez les patients atteints de cancers ou d’infections virales systémiques, permettant ainsi d’augmenter l’activité cytotoxique de leurs cellules NK. En combinaison avec des traitements anticancéreux ou antiviraux conventionnels, des inhibiteurs d’EAT-2 pourraient aider à endiguer les effets de ces maladies souvent dévastatrices. De tels inhibiteurs pourraient agir en bloquant l’interaction du domaine SH2 d’EAT-2 avec 2B4 ou l’association des tyrosines d’EAT-2 avec ses effecteurs intracellulaires. Nous proposons aussi que des altérations dans l’expression d’EAT-2 pourraient accroître la susceptibilité à des maladies comme le cancer, les infections virales ou les maladies auto-immunes.