Les lymphomes constituent un groupe hétérogène de pathologies caractérisées par la transformation néoplasique de cellules lymphoïdes. Ils se divisent en deux catégories : le lymphome hodgkinien classique (ou maladie de Hodgkin) et les lymphomes non-hodgkiniens (LNH), un groupe hétérogène de lymphomes. Dans le premier cas, les tumeurs sont, la plupart du temps, peu nombreuses et très localisées et, de plus, croissent relativement lentement. Au contraire, la plupart des LNH sont très agressifs et se propagent aux organes lymphoïdes, tels que les ganglions et la rate, de même que vers les organes non lymphoïdes. Les protocoles thérapeutiques visant à contrer la croissance et la propagation de ces cellules reposent essentiellement sur une polychimiothérapie dont l’intensité et la particularité dépendent du type de la tumeur et de l’âge du patient. L’identification de nouveaux gènes associés au développement des formes agressives des cancers lymphoïdes représente donc une étape importante dans la lutte contre cette maladie.
Afin d’identifier les gènes en cause dans l’évolution des formes agressives de ce type de cancer, nous avons voulu comparer le transcriptome de lymphomes métastatiques et non-métastatiques par matrice différentielle d’ADN complémentaire, une approche de plus en plus utilisée dans le domaine du cancer [ 1]. Pour ce faire, nous avons d’abord transformé par de multiples passages successifs in vivo des cellules de lymphomes faiblement métastatiques (peu agressives) en variants hautement agressifs ayant acquis la capacité de développer des tumeurs chez les souris génétiquement résistantes à la propagation de tumeurs lymphoïdes [ 2]. Puisque les cellules parentales non-métastatiques et leurs variants agressifs avaient des propriétés de migration identiques dans la circulation sanguine, soit la même efficacité à se rendre aux organes susceptibles de former des tumeurs secondaires, nous avions émis comme hypothèse que le comportement agressif de ces variants reflétait l’émergence d’un nouveau transcriptome constitué de gènes jouant un rôle dans la régulation des événements post-homing. Le homing des différentes cellules étant défini comme la capacité distincte des populations lymphoïdes à migrer vers les différents tissus cibles via des interactions cellulaires spécifiques médiées au niveau de la paroi vasculaire via des molécules d’adhérence exprimées à la fois à la surface des lymphocytes et des cellules endothéliales. Les événements post-homing se produisent donc lors des dernières étapes du processus métastatique, c’est-à-dire lorsque les cellules cancéreuses sortent de la circulation sanguine pour migrer à travers le parenchyme de l’organe cible, se frayant un chemin à travers la matrice extracellulaire afin de s’établir pour donner naissance à la formation de tumeurs secondaires. L’analyse comparative des transcriptomes des cellules non agressives et des variants hautement métastatiques nous a permis d’identifier plusieurs gènes dont l’expression était modulée de façon significative lors de la transition vers un phénotype agressif [ 3]. Parmi ces gènes, nous avons observé une forte augmentation de l’expression du gène de la galectine-7 (Figure 1).
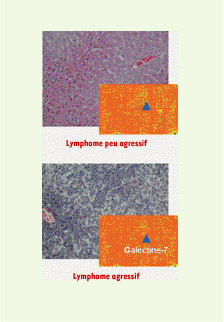
| Figure 1.
L’expression de la galectine-7 favorise l’infiltration du lymphome agressif. Les matrices différentielles d’ADN complémentaire ont permis d’analyser simultanément l’expression de plusieurs gènes, facilitant l’étude comparative de transcriptomes. L’évaluation du transcriptome d’un lymphome agressif met en évidence une forte expression de la galectine-7 en comparaison avec celui d’un lymphome peu agressif (▲). Ainsi, les coupes histologiques de foie des souris préalablement injectées avec un lymphome agressif exprimant la galectine-7 dévoilent une très forte infiltration de cellules de lymphome en comparaison avec le foie des souris injectées avec des lymphomes peu agressifs (coloration hématoxyline-éosine). |
Les galectines sont des protéines ayant une affinité particulière pour les β-galactosides, glycosides que l’on retrouve fréquemment sur les récepteurs cellulaires de nature glycoprotéinique [ 4]. Chez les mammifères, 14 membres de la famille des galectines ont été dénombrés jusqu’à présent. Présentes surtout sous forme cytosolique dans la cellule, les galectines sont également sécrétées dans le milieu extracellulaire par une voie non classique où elles peuvent accomplir diverses fonctions biologiques [ 5]. En ce qui concerne la galectine-7, on la retrouve exprimée principalement dans l’épiderme humain où elle est induite à la suite de l’exposition aux rayons ultraviolets [ 6]. En fait, on a surtout associé l’expression de la galectine-7 avec l’apoptose des kératinocytes lors d’exposition prolongée de la peau au soleil et considéré ce gène comme un marqueur d’épithéliums stratifiés [ 7].
Après avoir confirmé que la galectine-7 était également exprimée dans les LNH, nous avons récemment inséré dans les cellules lymphoïdes murines faiblement métastatiques le gène codant pour la galectine-7 afin de déterminer si cette protéine avait un effet sur l’évolution du lymphome. Nous avons pu ainsi démontrer que l’expression élevée de la galectine-7 dans les cellules cancéreuses accélère de façon significative la dissémination de cancers lymphoïdes dans les ganglions périphériques, la rate, de même que dans le foie et les reins [ 8]. En fait, le transfert du gène codant pour la galectine-7 dans les cellules non métastatiques peut, à lui seul, leur conférer la capacité de se propager chez des souris normalement résistantes à la formation de métastases, démontrant ainsi l’importance de cette protéine dans ce type de cancer. Afin de déterminer comment la galectine-7 peut exercer son influence dans le développement du cancer, nous avons examiné sa capacité à moduler l’expression d’autres gènes associés aux développements de cancers lymphoïdes, notamment les gènes codant pour les métalloprotéinases de la matrice extracellulaire (MMP), une famille de gènes reconnue comme jouant un rôle central dans la migration des cellules cancéreuses à travers la matrice extracellulaire [ 9]. Nous avons ainsi démontré que la galectine-7 induisait l’expression par la cellule cancéreuse de MMP-9 (Figure 2), une protéase précédemment associée à l’agressivité du LNH [ 10]. De plus, nous avons démontré que l’ajout de composés β-lactose, inhibiteurs de la liaison de galectine-7 avec ses récepteurs cellulaires, empêchait l’induction de MMP-9, laissant entrevoir la possibilité de neutraliser l’action de la galectine-7 à des fins thérapeutiques.
| Figure 2.
Évolution du lymphome vers un phénotype agressif. Le micro-environnement péritumoral exerce une pression sélective sur la tumeur, notamment via des interactions mettant en jeu les cellules péritumorales, la matrice extracellulaire, des facteurs de croissance, des cytokines, et plusieurs composantes de la réponse immunitaire. Ces interactions favorisent l’émergence de cellules tumorales agressives qui expriment un nouveau transcriptome leur permettant de s’adapter et de survivre dans ce nouveau micro-environnement. L’expression de la galectine-7 est induite dans les lymphomes agressifs lors de ce processus. Sa sécrétion a un effet autocrine sur la cellule tumorale en induisant, par la liaison à un ou à des récepteurs de surface, l’expression de MMP-9, une métalloprotéinase connue pour jouer plusieurs rôles dans le processus métastatique. La galectine-7 pourrait aussi avoir un effet paracrine sur les cellules péritumorales mais son rôle sur celles-ci reste encore à déterminer. |
En résumé, le rôle de la galectine-7 et son action dans l’évolution des cancers lymphoïdes représentent une découverte inattendue et fort intéressante puisqu’elle améliore la compréhension du processus de dissémination de certains cancers lymphoïdes. Des études plus approfondies nous permettront de déterminer quels types de cancers lymphoïdes pourront être ciblés. Des travaux sont en cours afin d’explorer les diverses stratégies susceptibles de mieux maîtriser son activité dans les cancers lymphoïdes.