| |
| Med Sci (Paris). 2005 August; 21(8-9): 730–736. Published online 2005 August 15. doi: 10.1051/medsci/2005218-9730.L’anémie de Fanconi : gènes et fonction(s) revisités Dora Papadopoulo* and Ethel Moustacchi Institut Curie, Section de recherche, UMR 218 CNRS, 26, rue d’Ulm, 75248 Paris Cedex 05, France |
L’anémie de Fanconi (AF), aplasie médullaire la plus fréquente chez l’enfant, est une maladie héréditaire rare (1 sur 300 000 naissances) décrite pour la première fois en 1927 par le pédiatre suisse Guido Fanconi [
1]. Les principaux signes cliniques sont indiqués dans l’encadré 1 [
2,
3]. L’AF est présente dans tous les groupes ethniques. La fréquence des hétérozygotes, estimée à un individu porteur sur 300, a été retrouvée plus élevée (1 sur 90) chez les Juifs ashkénazes ou dans la population blanche Afrikaner qui présentent, l’une et l’autre, un taux élevé de consanguinité [
4,
5]. Les cellules des patients AF ont souvent un taux élevé d’anomalies chromosomiques spontanées [
6], celui-ci étant considérablement augmenté après traitement avec des agents de pontage interbrins de l’ADN tels que le diépoxybutane, la mitomycine C (MMC), le cisplatine, les psoralènes photoactivés [2,
7]. Cette dernière caractéristique sert au diagnostic post et prénatal de la maladie [
8]. Divers processus cellulaires sont affectés dans l’AF sans que l’on connaisse encore ceux directement à l’origine de la maladie. Les principales anomalies cellulaires décrites dans la littérature [2, 7,
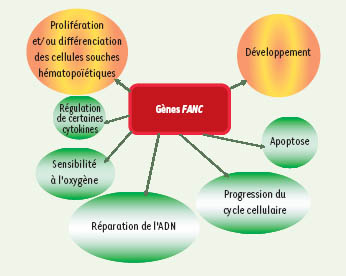
9] sont rapportées dans la Figure 1.  | Figure 1.
Principaux processus cellulaires affectés dans l’anémie de Fanconi. Tous les groupes génétiques de complémentation présentent un défaut de réparation de l’ADN lésé par des agents de pontages de l’ADN, des anomalies de la régulation du cycle cellulaire et de l’homéostasie de facteurs de croissance, de l’apoptose et de la détoxification d’intermédiaires actifs de l’oxygène [ 1, 2, 7, 9]. |

Les patients AF présentent une prédisposition accrue à développer certains types de cancers. L’incidence des leucémies myéloïdes aiguës est 15 000 fois plus élevée chez les enfants AF par rapport à la population infantile générale [
10]. Le risque combiné de tumeurs solides est augmenté de 50 fois, et pour certains types, il est 100 à 1 000 fois plus élevé que dans la population générale. Ainsi, les patients AF peuvent développer des carcinomes squameux des cavités buccale et vaginale (2 à 5 % des cas) et des carcinomes hépatocellulaires (10 % des cas) [
11], ces derniers étant peut-être dus aux androgènes utilisés dans le traitement de cette maladie. Actuellement, les thérapies mises en place visent à corriger l’anémie aplasique chez les patients AF. Les améliorations de la formule sanguine par les androgènes et les cytokines sont toutefois transitoires. Dans le cas où un donneur HLA-compatible est disponible, la greffe de moelle osseuse reste à ce jour le principal traitement relativement efficace. Le sang de cordon ombilical offre une source potentielle de cellules souches hématopoïétiques pour les patients AF sans appariement HLA [
12]. La procréation orientée par diagnostic pré-implantatoire, en vue d’une naissance d’un donneur immunologiquement compatible au sein d’une fratrie, est actuellement envisageable. Les espoirs se portent sur de nouvelles thérapies et depuis près de huit ans, la thérapie génique fait l’objet d’essais dont les résultats restent à ce jour décevants. L’utilisation de vecteurs rétroviraux porteurs de gènes normaux s’est avérée peu efficace et difficile à contrôler, sans que l’on sache si les échecs sont dus à la difficulté de délivrer le gène d’intérêt ou à celle de repeupler la moelle osseuse par les rares cellules corrigées. Or, une thérapie génique spontanée (« naturelle ») dans les cellules souches hématopoïétiques pluripotentes semble pouvoir se produire, puisque des cas de réversion spontanée conduisant à un mosaïcisme ont été rapportés [
13]. D’autres techniques utilisant des vecteurs plus efficaces, tels que les lentivirus, sont en cours d’élaboration. Leur avantage est de pouvoir transduire des cellules souches quiescentes et de réduire le temps nécessaire au transfert génique ex vivo de quelques jours à quelques heures. Des méthodes qui visent à délivrer le gène normal directement chez le patient sont également élaborées. Une alternative prometteuse est la thérapie cellulaire à l’aide de cellules souches isolées et caractérisées. Un essai clinique, actuellement en cours au Cincinnati children’s hospital medical center (États-Unis), combine la correction de cellules souches AF à l’aide d’un vecteur porteur du gène FANC normal et leur réimplantation chez le patient1. |
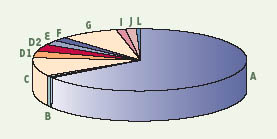
L’hétérogénéité clinique de l’AF s’accompagne d’une hétérogénéité génétique. En effet, onze groupes génétiques de complémentation ont été mis en évidence par hybridation somatique (AF-A, B, C, D1, D2, E, F, G, I, J et L). Près de 85 % des patients AF appartiennent aux groupes de complémentation A, C et G, le groupe A étant le plus fréquemment rencontré (66 %) (Figure 2). A chaque groupe de complémentation correspondrait un gène FANC unique. À ce jour, neuf des gènes FANC sont identifiés : C , A , G , F , D2 , E , D1 , L et B (en ordre chronologique) [2,
14–
16]. L’identification de FANCD1 a constitué une découverte surprenante. En effet, les patients appartenant au groupe de complémentation AF-D1 portent des mutations bialléliques dans le gène BRCA2 , l’un des deux gènes majeurs impliqués dans la prédisposition génétique au cancer du sein et de l’ovaire. L’introduction de l’ADNc du gène BRCA2 dans les cellules AF-D1 corrige l’hypersensibilité à la MMC, indiquant que FANCD1 et BRCA2 sont un seul et même gène [14]. Par ailleurs, jusqu’ici, l’AF était considérée comme une maladie autosomique. Or, tout récemment, le gène FANCB a été identifié et localisé sur le chromosome X [16]. 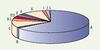 | Figure 2.
Prévalence relative des gènes FANC fondée sur l’analyse de 241 familles AF classées dans le cadre de programmes européens de recherche sur l’anémie de Fanconi (1994-2003).
FANCA : 66 % ; B : 1,5 % ; C : 9,5 % ; D1 : 3,2 % ; D2 : 3,3 % ; E : 2,5 % ; F : 2 % ; G : 8 % ; I : 1,5 % ; J : 1,5 % ; L : 1 % [
21]. |
Les gènes FANC identifiés sont localisés sur des régions chromosomiques différentes. Ils sont constitués de 1 à 44 exons et codent pour des protéines de tailles différentes (d’une centaine à plus de 3000 acides aminés) qui présentent très peu d’homologies entre elles. À l’exception de D1(BRCA2) et D2 , les gènes FANC n’ont des homologues que chez les vertébrés. Des homologues de D1(BRCA2) ont été en effet retrouvés dans d’autres espèces, telles que le moustique, certains parasites dont le trypanosome, le champignon Ustilago maydis et certaines plantes dont le riz et Arabidopsis thaliana [
17]. Le domaine le plus conservé entre la protéine D1(BRCA2) et ses orthologues correspond à la région carboxyterminale. Le gène FANCD2 , quant à lui, possède des homologues chez Drosophila melanogaster , Xenopus,
Caenorhabditis elegans et Arabidopsis thaliana [
18]. La conservation de D1 et D2 au cours de l’évolution suggère que ces protéines participent à une voie métabolique essentielle. Les protéines FANC identifiées à ce jour sont retrouvées dans tous les tissus, avec toutefois une expression plus élevée dans le thymus et les testicules [1, 9]. Les protéines A, C, G et F sont présentes à la fois dans le cytoplasme et le noyau [
19], tandis que les autres protéines FANC sont exclusivement nucléaires [18,
20]. Des modèles murins ont été établis pour certains des gènes FANC [2]. Cependant, ils n’ont pas apportés à ce jour d’indications nouvelles sur leur fonction et ne seront donc pas discutés ici. |
L’étude biochimique des interactions entre les protéines FANC indique que sept de ces protéines, A, B, C, E, F, G et L s’associent pour former un complexe nucléaire [2, 19]. L’absence d’une seule de ces protéines empêche la formation du complexe. En effet, celui-ci ne se forme pas dans les cellules AF-A, B, C, E, F, G et L [2, 8]. En revanche, il est présent dans les cellules AF-D1, D2, I et J [2, 21]. Les étapes moléculaires de la formation du complexe FANC ne sont pas encore précisément connues. Celle-ci semble débuter dans le cytoplasme par l’interaction directe entre A et G, puis C et F. Le complexe A/C/F/G est transporté dans le noyau où les protéines B, E et L s’y joignent [14, 19–
23]. La protéine FANCB semble être étroitement liée à FANCL et est nécessaire à sa stabilisation [16]. Lors de la formation du complexe, la protéine FANCG jouerait un rôle de plateforme car elle interagit directement avec A, B, C, E et F [
24]. Quatre formes distinctes du complexe FANC ont été récemment décrites (Tableau I) suggérant des fonctions différentes dépendantes de leur localisation subcellulaire [
25].  | Tableau I.
Protéines du complexe FANC. Les protéines du complexe FANC sont retrouvées dans les différents compartiments cellulaires sous quatre formes distinctes : (1) une forme cytoplasmique, d’environ 600 kDa, dont la quantité diminue en présence de dommages induits par la mitomycine C (MMC) ; (2) une forme cytoplasmique de 750 kDa présente pendant la mitose ; (3) une forme nucléaire de 2 MDa dont la quantité augmente après traitement par la MMC ; (4) une forme intermédiaire de 1 MDa, liée à la chromatine, et dont la quantité augmente après traitement par la MMC [ 25]. L’appartenance à ces différentes formes du complexe des produits des gènes FANCB et L, récemment clonés, n’est pas connue à ce jour. |
Les protéines FANCD1, D2, I et J ne font pas partie du complexe et ne sont pas nécessaires à sa formation et à sa stabilisation dans le noyau [8, 14, 21]. FANCI semble agir en amont de complexe, tandis que D1, D2 et J agiraient en aval de celui-ci. La protéine D2 possède deux isoformes : l’une native D2-S et l’autre mono-ubiquitinylée D2-L [
22]. Cette dernière forme n’est pas retrouvée dans les cellules des groupes de complémentation AF-A, B, C, E, F, G et L. La présence d’un complexe fonctionnel FANC est donc nécessaire à la mono-ubiquitinylation de FANCD2. Une interaction directe entre E et D2-S a été découverte, indiquant un lien moléculaire entre D2 et le complexe FANC [20, 24]. La modification post-transcriptionnelle de D2 est à présent utilisée pour la détection rapide des patients AF-D2 et pour distinguer les patients AF dont le gène muté fait partie ou non du complexe FANC [
26,
27]. La mono-ubiquitinylation de FANCD2 se produit en présence de lésions de l’ADN formées au cours de la réplication ou induites par des agents génotoxiques tels que les radiations ionisantes et ultraviolettes ou les agents pontants [22]. En présence de lésions, on retrouve la protéine D2 mono-ubiquitinylée dans des foyers subnucléaires, où elle colocalise avec le produit du gène BRCA1 , impliqué dans la prédisposition au cancer du sein et de l’ovaire [22]. Dans ces foyers, on retrouve aussi RAD51, l’une des protéines-clés de la réparation des cassures double brin de l’ADN (CDB) par la voie de la recombinaison homologue. Les foyers D2-L ne sont pas retrouvés dans les cellules où le complexe est absent [22]. FANCL, récemment découverte, est la première protéine FANC ayant une activité enzymatique clairement identifiée. Elle contient un motif de type PHD (plant homeodomain) à doigt de zinc possédant une activité E3 ubiquitine ligase et participerait à la mono-ubiquitinylation de D2 [
15]. Sachant que L est un des membres du complexe FANC, cette protéine jouerait un rôle majeur dans la mono-ubiquitinylation de D2. |
FANC et BRCA : une surprenante collaboration En absence de BRCA1, D2 n’est pas mono-ubiquitinylée et les foyers D2-L induits par les dommages de l’ADN ne sont pas formés. BRCA1 jouerait donc un rôle important dans la régulation de la modification post-traductionelle de D2. Sachant que BRCA1, en association avec BARD1 (BRCA1 associated ring domain 1) , a une activité E3 ubiquitine ligase, il a été suggéré que D2 servirait de substrat à l’hétérodimère BRCA1/BARD1. Ainsi, la présence de BRCA1 et de FANCL est nécessaire pour la mono-ubiquitinylation de D2. Cependant, on ne sait pas encore si les deux protéines sont impliquées directement dans la modification post-traductionelle de D2 in vivo ou si l’une des deux agit indirectement en stabilisant le complexe FANC. Il a été démontré que FANCA interagit directement avec BRCA1 [
28] et E interagit avec D2-S [20]. Il a donc été proposé que le complexe FANC permettrait de mettre en contact D2 et BRCA1. Quant à la protéine D1(BRCA2), il a été rapporté qu’elle interagit d’une part avec G [
29] et d’autre part avec E et avec la forme mono-ubiquitinylée de D2 (D2-L) [
30]. L’ensemble de ces données indique que les produits des gènes BRCA et FANC sont étroitement associés et participent à une même voie activée en présence de lésions graves de l’ADN telles que les CDB et les pontages interbrins. En présence d’ADN lésé, on constate que la forme D2-L s’associe à la chromatine et qu’elle entraîne la liaison de D1(BRCA2) à cette chromatine endommagée. L’ubiquitinylation, de même que la phosphorylation, sont des processus dynamiques et réversibles. Récemment, une enzyme de désubiquitinylation USP1 agissant spécifiquement sur FANCD2-L, a été identifié [
31]. Elle pourrait participer à la régulation de la voie métabolique FANC en réponse aux dommages de l’ADN. |
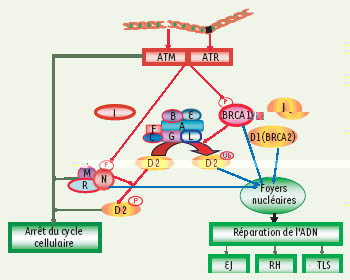
Le complexe FANC/BRCA fait partie d’un réseau métabolique incluant ATM et le complexe MRE11/RAD50/NBS1 On retrouve le complexe FANC/BRCA au sein d’un réseau finement orchestré auquel participent un grand nombre de protéines dont les produits des gènes ATM , MRE11 , NBS1 , ATR. Ceux-ci sont impliqués dans des maladies héréditaires prédisposant au cancer dont l’ataxie télangiectasie (ATM), l’AT-LD, un syndrome similaire à l’ataxie télangiectasie (MRE11), le syndrome de Nijmegen (NBS1), le syndrome de Seckel (ATR). Ce réseau contrôle la gestion des lésions qui bloquent la réplication de l’ADN (Figure 3) et en particulier la progression de la phase S du cycle cellulaire. L’ATM et son activité kinase y jouent un rôle central en phosphorylant, en réponse aux radiations ionisantes, divers substrats dont les protéines FANCD2 [
32], BRCA1 et NBS1, membres du complexe M/R/N (MRE11/RAD50/NBS1). La phosphorylation de FANCD2, indépendante de sa mono-ubiquitinylation, serait impliquée dans l’activation du point de contrôle de la phase S radio-induite (Figure 3). La protéine NBS1 étant requise pour la phosphorylation de D2 par ATM, il a été suggéré que la coopération de la voie FANC/BRCA et le complexe M/R/N sont nécessaires pour activer le point de contrôle de la phase S. D’autre part, la forme D2-L co-localise avec NBS1, MRE11 et RAD50 dans les foyers nucléaires formés après traitement avec des agents pontant l’ADN. Le complexe M/R/N coopère donc avec FANC lors de la réparation des lésions induites par ces agents [
33]. 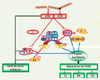 | Figure 3.
Schéma simplifié de la voie FANC/BRCA au sein d’un réseau multiprotéique activé en présence de lésions bloquant la réplication de l’ADN (cassures double brin de l’ADN ou pontages interbrin). Les protéine kinases ATM et/ou ATR phosphorylent BRCA1, NBS1(N), FANCD2 qui arrêtent la progression de la phase S du cycle cellulaire. L’action des différents membres de ce réseau est nécessaire pour détecter les lésions et recruter aux sites des dommages les composants de la machinerie de la réparation appropriée : excision de nucléotides (NER), recombinaison homologue (RH), voie end-joining (EJ), synthèse translésionnelle (TLS). M/R/N : complexe MRE11/RAD50/NSB1 ; D2 : protéine FANCD2 ; A, B, C, E, F, G, L : les sept protéines FANC du complexe nucléaire ; I : protéine FANCI ; J : protéine FANCJ. |
ATM n’est pas la seule kinase qui participe à la phosphorylation des protéines FANC. En effet, dans les cellules ATM−/−
exposées à des agents génotoxiques tels que l’hydroxyurée ou la MMC, FANCD2 est phosphorylée. Cela suggère que, suivant le type de dommage, d’autres kinases interviennent dans la phosphorylation des protéines FANC (Figure 3). La kinase ATR semble intervenir lors de la modification post-transcriptionnelle (phosphorylation et mono-ubiquitinylation) de FANCD2 en présence des pontages interbrins de l’ADN [
34,
35]. Il a été montré que la protéine RPA1, qui détecte et se lie à l’ADN simple brin, est aussi nécessaire à la modification post-transcriptionnelle de FANCD2 [34]. Sachant que cette protéine recrute ATR aux régions d’ADN simple brin, il est possible que lors de la réparation des lésions induites par des radiations ionisantes ou par des agents pontants, des ADN simple brin sont créés, puis détectés par RPA1 qui recruterait les kinases appropriées, ATM ou ATR. Ces kinases, via une série de modifications post-transcriptionelles impliquant, entre autres, les produits des gènes FANC , déclenchent alors la réponse cellulaire à ces lésions. |
Du gène à la fonction : les partenaires des protéines FANC suggèrent des pistes Si la fonction précise des gènes FANC est encore mal connue, celles de certains de leurs partenaires, en particulier ATM et NBS1 [
36], sont mieux documentées. De nombreux travaux suggèrent que le complexe M/R/N contribue à la détection et/ou à la signalisation des CDB, participe à la machinerie de réparation des CDB (par recombinaison homologue et par la voie end-joining) et a une fonction importante dans la régulation du cycle cellulaire [
37]. Un nombre croissant de données révèle que BRCA1 est impliqué aussi à la fois dans la réparation des CDB et dans le contrôle du cycle cellulaire en réponse aux radiations ionisantes. L’association de FANC avec ATM, NBS1 et BRCA1 suggère que les gènes FANC seraient aussi impliqués dans la gestion de lésions bloquant la réplication de l’ADN, telles que les CDB ou les pontages interbrin. Cela est en accord avec les données précédemment rapportées sur la réparation inefficace ou infidèle des pontages interbrins [
38–
42] ou des CDB [
43,
44], l’arrêt inefficace de la progression de la phase S [
45,
46] et l’allongement de la phase G2 du cycle cellulaire dans les cellules AF [
47]. Les produits des gènes FANC participeraient donc à la détection ou à la signalisation des lésions à la machinerie de contrôle du cycle cellulaire et de la réparation. Via la mono-ubiquitinylation de D2, les protéines FANC pourraient être également impliquées dans le choix du processus de réparation des CDB, la forme D2-S l’orientant vers la voie end-joining et la forme D2-L vers la voie de la recombinaison homologue. L’inactivation de l’un des membres du réseau ATM/MRE11/RAD50/NBS1/BRCA/FANC conduit à une réparation inefficace ou infidèle des CDB, directement induite par les radiations ionisantes ou indirectement produite lors de la réparation des pontages interbrins de l’ADN (Figure 3). Cela entraîne une instabilité génétique caractéristique de l’ensemble des syndromes dans lesquels ces gènes sont impliqués. Néanmoins, le fait que le produit de chacun de ces gènes a une fonction précise au sein de ce réseau pourrait expliquer que leur inactivation chez l’homme conduit à des syndromes différents se traduisant par des manifestations cliniques et cellulaires distinctes. Il a été suggéré que l’inactivation des gènes D2 , D1(BRCA2), I et J , dont les produits se situent en dehors du complexe FANC, conduit aux formes cliniques les plus sévères de l’AF. Par exemple, les patients ayant des mutations dans D1 (BRCA2) développent très rapidement une leucémie myéloïde aiguë, une tumeur de Wilms ou un médulloblastome [
48]. Des études récentes suggèrent que l’inactivation d’un des gènes FANC dans les cellules somatiques pourrait être un facteur facilitant la progression du processus tumoral. Ainsi, des délétions somatiques dans le gène FANCA ont été retrouvées dans des cas sporadiques de leucémie myéloïde aiguë [
49]. D’autre part, dans une proportion importante de tumeurs du col de l’utérus invasives ou de l’ovaire, l’expression de FANCF est fortement réduite, due à l’hyperméthylation de son promoteur [
50,
51]. En d’autres termes, non seulement des mutations dans la lignée germinale, mais aussi l’inactivation de novo des gènes FANC par mutations somatiques ou par extinction epigénétique de leur expression, est un facteur qui contribue à la progression de certains types de leucémies ou de cancers épithéliaux dans la population générale. |
Conclusions et perspectives D’importantes avancées ont eu lieu ces dernières années dans la compréhension de la fonction des gènes impliqués dans l’AF. Il est clair que des mutations dans ces gènes affectent non seulement plusieurs voies de réparation telles que la recombinaison homologue, la voie end-joining , la synthèse translésionnelle, mais aussi le contrôle de la progression de la phase S du cycle cellulaire en présence de lésions spécifiques bloquant la réplication de l’ADN. Les produits des gènes FANC participeraient donc à la détection et à la signalisation des fourches de réplication bloquées et/ou dans la résolution de ces blocages via différentes voies de réparation. Cependant des interrogations persistent. Pourquoi les cellules AF ne sont-elles pas sensibles à des agents qui bloquent la réplication en dehors de ceux qui pontent l’ADN ? Quel est le signal chimique qui déclenche la mono-ubiquitinylation de FANCD2 et comment cette modification régule les événements consécutifs ? Si la forme non-mono-ubiquitinylée de FANCD2 a aussi une fonction propre, quel est dans ce cas le rôle précis de chacune des protéines FANC participant dans le complexe ? Pourquoi les cellules de mammifères ont-elles besoin d’autant de gènes FANC ? Existe-t-il un lien entre la complexité de l’organisation de l’ADN en chromatine, la difficulté d’accès aux régions endommagées qui en résulte et le grand nombre de gènes FANC impliqués ? Le décryptage du (des) rôle(s) des gènes FANC devrait aider à mieux comprendre la séquence des événements moléculaires à la base de la réponse cellulaire aux lésions qui menacent l’intégrité du génome et à l’origine de la prédisposition génétique aux cancers. De plus, la compréhension de la régulation des gènes FANC par extinction épigénetique de leur expression devrait non seulement apporter des éléments de réponse concernant certains cancers sporadiques, mais pourrait également avoir des implications importantes dans l’amélioration des protocoles de chimio- et de radiothérapie fondés sur le génotype des tumeurs. |
Nos travaux ont été financés par l’Institut Curie, le Centre National pour la Recherche Scientifique, l’Association pour la Recherche sur le Cancer (contrats n° 4333 et n°3382), EDF-Radioprotection (contrats n° RB 2002-08 et n° RB 2004-22), et la Commission des Communautés Européennes (FIGH-CT-1999-00010 et FIGH-CT-2002-00207).
|
Footnotes |
1. Fanconi G. Familiäre infantile perniziosaartige Anämie (perniziöses Blutbild und Konstitution). Jahrb Kinderheilk 1927; 117 : 257–80. 2. Auerbach AD, Buchwald M, Jonje A. Fanconi anemia. In : Vogelstein B, Kinzler KW, eds. The genetic basis of human cancer. New York : McGraw-Hill, 1998 : 317–32. 3. D’Andrea AD, Grompe M. The Fanconi anemia/BRCA pathway. Nat Rev Cancer 2003; 3 : 23–34. 4. Fanconi G. Familial constitutional panmyelocytopathy, Fanconi’s anemia (FA). I. Clinical aspects. Semin Hematol 1967; 4 : 233–40. 5. Swift M. Fanconi’s anemia in the genetics of neoplasia. Nature 1971; 230 : 370–3. 6. Verlander PC, Kaporis A, Liu Q, et al. Carrier frequency of the IVS4+4A>T mutation of the Fanconi anemia FAC in the Ashkenasi Jewish population. Blood 1995; 86 : 4034–8. 7. Schroeder TM, Kurt R. Spontaneous chromosome breakage and high incidence of leukemia in inherited disease. Blood 1971; 37 : 96–112. 8. Joenje H, Patel KJ. The emerging genetic and molecular basis of Fanconi anaemia. Nature Rev Genet 2001; 2 : 446–57. 9. Buchwald M, Moustacchi E. Is Fanconi anemia caused by a defect in the processing of DNA damage ? Mutation Res 1998; 408 : 75–90. 10. Auerbach AD. Fanconi anemia diagnosis and the diepoxybutane (DEB) test. Exp Hematol 1993; 21 : 731–3. 11. Auerbach AD, Allen RG. Leukemia and preleukemia in Fanconi anemia patients : a review of the literature and report of the International Fanconi Anemia Registry. Cancer Genet Cytogenet 1991; 51 : 1–15. 12. Rosenberg PS, Greene MH, Alter BP. Cancer incidence in persons with Fanconi anemia. Blood 2003; 101 : 822–6. 13. Gluckman E, BroxmeyerR HE, Auerbach AD, et al. Hematopoietic reconstitution in a patient with Fanconi’s anemia by means of umbilical cord blood from an HLA-identical sibling. N Engl J Med 1989; 321 : 1174–8. 14. Gregory JJ., Wagner JE, Verlander PC, et al. Somatic mosaicism in Fanconi anemia : evidence of genotypic reversion in lymphohematopoietic stem cells. Proc Natl Acad Sci USA 2001; 98 : 2532–7. 15. Howlett NG, Taniguchi T, Olson S, et al. Biallelic inactivation of BRCA2 in Fanconi anemia. Science 2002; 297 : 606–9. 16. Meetei AR, de Winter JP, Medhurst AL, et al. A novel ubiquitin ligase is deficient in Fanconi anemia. Nature Genet 2003; 35 : 165–70. 17. Meetei AR, Levitus M, Xue Y, et al. X-linked inheritance of Fanconi anemia complementation group B. Nature Genet 2004; 36 : 1219–24. 18. Warren M, Smith A, Partridge N, et al. Structural analysis of the chicken BRCA2 gene facilitates identification of functional domains and disease causing mutations. Hum Mol Genet 2002; 11 : 841–51. 19. Timmers C, Taniguchi T, Hejna J, et al. Positional cloning of a novel Fanconi FANCD2. Mol Cell 2001; 7 : 241–8. 20. Garcia-Higuera I, Kuang Y, Naf D, et al. The Fanconi anemia proteins, FANCA, FANCC and FANCG/XRCC9 interact in a functional nuclear complex. Mol Cell Biol 1999; 19 : 4866–73. 21. Pace P, Johnson M, Tan WM, et al. FANCE : the link between Fanconi anemia complex assembly and activity. EMBO J 2002; 21 : 3414–23. 22. Levitus M, Rooimans MA, Steltenpool J, et al. Heterogeneity in Fanconi anemia : evidence for 2 new genetic subtypes. Blood 2004; 103 : 2498–2503. 23. Garcia-Higuera I, Taniguchi T, Ganesan S, et al. Interaction of the Fanconi anemia proteins and BRCA1 in a common pathway. Mol Cell 2001; 7 : 249–62. 24. Medhurst AL, Huber PA, Waisfisz Q, et al. Direct interaction of the five known Fanconi anaemia proteins suggest a common functional pathway. Hum Mol Genet 2001; 10 : 423–9. 25. Gordon SM, Buchwald M. Fanconi anemia protein complex : mapping proteins interactions in the yeast 2- and 3-hybrid systems. Blood 2003; 102 : 136–41. 26. Thomashevski A, High AA, Drozd M, et al. The Fanconi anemia core complex forms four complexes of different sizes in different subcellular compartments. J Biol Chem 2004; 279 : 26201–9. 27. Schimamura A, de Oca RM, Svenson JL, et al. A novel diagnostic screen for defects in the Fanconi anemia pathway. Blood 2002 ; 100; 4649–54. 28. Soulier J, Leblanc T, Larghero J, et al., Detection of somatic mosaicism and classification of Fanconi anemia patients by analysis of the FA/BRCA pathway. Blood 2005; 105 :1329–36. 29. Folias A, Matkovic M, Bruun D, et al. BRCA1 interacts directly with the Fanconi anemia protein FANCA. Hum MolGenet 2002; 11 : 2591–7. 30. Hussain SE, Witt PA, Huber AL, et al. Direct interaction of the Fanconi anemia protein FANCG with BRCA2/FANCD1. Hum Mol Genet 2003; 12 : 2503–10. 31. Wang XZ, Andreassen PR, d’Andrea AD. Functional interaction of monoubiquitinated FANCD2 and BRCA2/FANCD1 in chromatin. Mol Cell Biol 2004; 24 : 5850–62. 32. Nijman SMB, Huang TT, Dirac AMG, et al. The deuibiquitinating enzyme USP1 regulates the Fanconi anemia pathway. Mol Cell 2005; 17 : 331–9. 33. Taniguchi T, Garcia-Higuera I, Xu B, et al. Convergence of the Fanconi anemia and ataxia telangiectasia signaling pathways. Cell 2002; 109 : 459–72. 34. Nakanishi K, Taniguchi T, Ranganathan V, et al. Interaction of FANCD2 and NBS1 in the DNA damage response. Nat Cell Biol 2002; 4 : 913–20. 35. Pichierri P, Rosselli F. The DNA crosslink-induced S-phase checkpoint depends on ATR-CHK1 and ATR-NBS1-FANCD2 pathways. EMBO J 2004; 23 : 1178–87. 36. Andreassen PR, D’Andrea A, Taniguchi T. ATR couples FANCD2 monoubiquitination to the DNA-damage response. Genes Dev 2004; 18 : 1958–63. 37. Shiloh Y. ATM and related protein kinases : safeguarding genome integrity. Nat Rev Cancer 2003; 3 : 155–8. 38. D’Amours D, Jackson SP. The Mre11 complex : at the crossroads of DNA repair and checkpoint signaling. Nat Rev Mol Cell Biol 2002; 5 : 317–27. 39. FujiwaraY, Tatsumi M. Cross-link repair in human cells and its possible defect in Fanconi’s anemia cells. J Mol Biol 1977; 113 : 635–49. 40. Papadopoulo D, Averbeck D, Moustacchi E. The fate of 8-methoxypsoralen photoinduced DNA interstrand cross-links in Fanconi’s anemia cells of defined genetic complementation groups. Mutat Res 1987; 184 : 271–80. 41. Rousset S, Nocentini S, Revet B, Moustacchi E. Molecular analysis by electron microscopy of the removal of psoralen-photoinduced DNA cross-links in normal and Fanconi’s anemia fibroblasts. Cancer Res 1990; 50 : 2443–8. 42. Papadopoulo D, Guillouf C, Mohrenweiser H, Moustacchi E. Hypomutability in Fanconi anemia cells is associated with increased deletion frequency at the HPRT locus. Proc Natl Acad Sci USA 1990; 87 : 8383–7. 43. Lambert MW, Tsongalis GJ, Lambert WC, et al. Defective DNA endonuclease activities in Fanconi’s anemia cells, complementation groups A and B. Mutat Res 1992; 273 : 57–71. 44. Escarceller M, Buchwald M, Singleton BK, et al. Fanconi anemia C gene product plays a role in the fidelity of blunt DNA end-joining. J Mol Biol 1998; 279 : 375–85. 45. Lundberg R, Mavinakere M, Campbell C. Deficient DNA end joining activity in extracts from Fanconi anemia fibroblasts. J Biol Chem 2001; 276 : 9543–9. 46. Centurion SA, Kuo HR, Lambert WC. Damage-resistant DNA synthesis in Fanconi anemia cells treated with a DNA cross-linking agent. Exp Cell Res 2000; 260 ; 216–21. 47. Sala-Trepat M, Rouillard D, Escarceller M, et al. The arrest of S-phase progression is impaired in Fanconi anemia cells. Exp Cell Res 2000; 260 : 208–15. 48. Dutrillaux B, Aurias A, Dutrillaux AM, et al. The cell cycle of lymphocytes in Fanconi anemia. Hum Genet 1992; 62 : 327–32. 49. Hursh B, Shimamura A, Moreau L, et al. Association of biallelic BRCA2/FANCD1 mutations with spontaneous chromosomal instability and solid tumors of childhood. Blood 2004; 103 : 2554 –9. 50. Tischkowitz MD, Morgan NV, Grimwade D, et al. Deletion and reduced expression of the Fanconi anemia FANCA gene in sporadic acute myeloid leukemia. Leukemia 2004; 18 : 420–5. 51. Narayan G, Arias-Pulido H, Nandula SV, et al. Promoter hypermethylation of FANCF : disruption of Fanconi anemia-BRCA pathway in cervical cancer. Cancer Res 2004; 64 : 2994–7. |