| |
| Med Sci (Paris). 2005 March; 21(3): 297–301. Published online 2005 March 15. doi: 10.1051/medsci/2005213297.Données nouvelles sur la prévention nutritionnelle de l’ostéoporose Véronique Coxam* Groupe Ostéoporose, U3M, INRA Theix, 63122 Saint-Genès Champanelle, France |
Les sociétés occidentales connaissent une évolution démographique importante puisque la longévité atteint, selon une estimation de 1996, 80,5 ans chez la femme, et 74 ans environ chez l’homme. Cet allongement de l’espérance de vie a pour conséquence une modification de la morbidité générale tendant vers une augmentation des maladies dégénératives. L’ostéoporose, affection chronique résultant d’une détérioration, liée à l’âge, de l’architecture du tissu osseux et d’une réduction du contenu minéral de l’os qui engendrent une fragilisation du squelette, est ainsi devenue un problème majeur de santé publique [
1]. En effet, chez la femme caucasienne de la cinquantaine, le risque cumulé sur les années de vie restantes de développer cette affection atteint 40 % (contre 13 % chez l’homme) et, au-delà de 80 ans, 70 % de la population féminine est ostéoporotique. À l’échelon national, 50 000 nouvelles fractures non traumatiques du col fémoral et 45 000 fractures du poignet sont diagnostiquées chaque année, avec vraisemblablement autant de tassements vertébraux [
2]. La France n’a bien sûr pas l’apanage de cette maladie largement répandue sur le globe : outre-Atlantique, 25 millions d’Américains souffrent d’ostéoporose. Selon des études prospectives, ces données devraient s’aggraver puisque, au niveau européen, on estime que le nombre de fractures de la hanche devrait augmenter de 135 % d’ici 50 ans et la prévalence des tassements vertébraux de 75 %. Il est donc impératif d’améliorer la prévention de l’ostéoporose. À la suite des études récentes montrant notamment l’augmentation du risque relatif de cancer du sein chez les femmes sous hormonothérapie substitutive, ce traitement, classiquement prescrit, ne doit plus être considéré en première intention dans la prévention de l’ostéoporose1. Les professionnels de santé sont donc confrontés à la difficulté de développer de nouvelles stratégies. La prise de conscience du rôle protecteur éventuel de certains micronutriments a permis l’émergence du concept de nutrition préventive. L’alimentation de la personne âgée est ainsi au centre d’une réflexion sur des mesures préventives, concernant l’ostéoporose pouvant avoir un impact important en santé publique. |
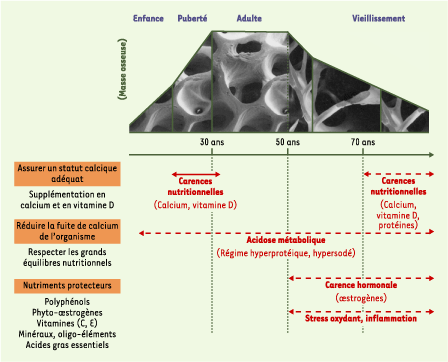
Les règles d’or de la prévention nutritionnelle Une alimentation équilibrée durant toute la vie est fondamentale pour l’optimisation du capital osseux et sa conservation ultérieure. Si des recommandations alimentaires ne sauraient se substituer à toute intervention thérapeutique, un accompagnement nutritionnel doit néanmoins être proposé. La prise en charge doit être précoce, car la période de croissance (permettant l’acquisition de la masse osseuse maximale) et le vieillissement (conditionnant la vitesse de perte osseuse) sont deux phases critiques pour le squelette. Certaines carences nutritionnelles constituent des facteurs majeurs de morbidité et de mortalité. Notre alimentation fournit non seulement les nutriments essentiels à la couverture des besoins métaboliques, mais aussi un panel de molécules actives présentes dans le règne végétal, pouvant contribuer au maintien d’un état de santé optimal. La prévention nutritionnelle de l’ostéoporose a pour objectif, d’une part, d’assurer un statut optimal en calcium (99 % du calcium de notre organisme est stocké au niveau du squelette, conditionnant ses propriétés biomécaniques) et en vitamine D et, d’autre part, de fournir un certain nombre de micronutriments protecteurs (Figure 1).
 | Figure 1.
Les règles de la prise en charge nutritionnelle de l’ostéoporose. Les différents facteurs étiologiques impliqués dans le déterminisme de la perte osseuse évoluent au cours de la vie. Ainsi, des carences nutritionnelles (notamment en calcium, vitamine D et protéines) sont très délétères pour l’acquisition du capital osseux et constituent également une des causes majeures de l’ostéopénie liée au vieillissement. Une alimentation déséquilibrée sur le plan ionique peut également produire une acidose métabolique associée à une fuite urinaire du calcium. Enfin, la carence hormonale liée à la ménopause est à l’origine de l’ostéoporose de type I. Elle se traduit par le développement d’une inflammation et d’un stress oxydant chroniques qui s’exacerbent avec l’âge. Pour pallier ces différentes situations, une approche nutritionnelle peut être envisagée, puisqu’une alimentation équilibrée permet non seulement de couvrir les besoins en calcium et en vitamine D, mais aussi de fournir des micronutriments protecteurs. |
De façon pragmatique, des recommandations adaptées permettront de cibler spécifiquement les besoins du squelette en fonction du statut physiologique. En effet, selon la classification en vigueur, l’ostéoporose post-ménopausique à expression essentiellement vertébrale résulte des perturbations hormonales engendrées par la ménopause. L’ostéoporose sénile dépend, quant à elle, des problèmes de carence calcique et vitaminique D et d’une exacerbation des processus inflammatoires et oxydatifs apparaissant à la ménopause. Assurer un statut optimal en calcium et en vitamine D En France, les apports journaliers conseillés en calcium sont de 1200 mg pour les femmes de plus de 55 ans et pour tous les sujets après 65 ans [
3]. Des carences marginales en calcium peuvent être observées dans la population. Les trois groupes à risque sont les adolescentes, les femmes âgées de plus de 55 ans et les personnes de plus de 80 ans vivant en institution. Par conséquent, la correction des déficits éventuels devrait précéder ou accompagner toute thérapeutique spécifique en matière d’ostéoporose. La plupart des travaux démontrent les limites d’une supplémentation calcique sur le processus d’ostéopénie si elle est administrée dans les cinq ans qui suivent la ménopause (l’impact de la carence hormonale étant prépondérant) [
4]. Le principe d’une supplémentation en calcium chez la personne âgée est consensuel. En revanche, chez l’adulte, l’intérêt d’une telle démarche n’est pas toujours avéré. Selon une enquête récente [
5], il n’existe pas de problème majeur d’apport calcique chez les hommes de 18 à 70 ans. Le concept d’apport optimal fait appel à la notion de biodisponibilité qui dépend de l’absorption intestinale et de l’utilisation métabolique de l’élément considéré. Ainsi, le calcium ingéré ne correspond pas à la fraction absorbée, en raison de la barrière intestinale. La potentialisation de l’absorption du calcium par la vitamine D a conféré à cette molécule un rôle clé dans la prévention de l’ostéoporose sénile car une carence en vitamine D chez les sujets âgés de plus de 65 ans est fréquemment observée [
6]. Cela explique l’efficacité d’une supplémentation nutritionnelle chez la personne âgée, avec des répercussions favorables sur le tissu osseux, cette stratégie étant d’ailleurs préconisée dans la prise en charge de l’ostéoporose sénile [
7]. La première démarche pour optimiser le statut calcique consiste donc à s’assurer de la couverture des besoins en calcium et en vitamine D. Limiter les pertes calciques par une alimentation équilibrée Une alimentation riche en calcium n’est, toutefois, pas un gage de consolidation osseuse car ce minéral est un nutriment de type « seuil ou plateau » (au-delà d’une valeur critique, aucun bénéfice n’est démontré avec l’augmentation de la consommation). De plus, la qualité du squelette dépend du bilan calcique, lui-même tributaire non seulement des apports, mais aussi des pertes, généralement non maîtrisées par la seule supplémentation calcique. Notre alimentation de type occidental peut justement contribuer à cette fuite de calcium. Un régime hypersodé peut induire, via une diminution de la réabsorption tubulaire rénale, une augmentation de l’excrétion urinaire de calcium (lorsque la natriurèse atteint 150 mmol/24h). Ainsi, chaque gramme supplémentaire de Na+ consommé entraîne la fuite de 40 à 60 mg de calcium [
8], ce qui induirait une perte osseuse additionnelle de 1 % si la totalité du calcium urinaire provenait du squelette. Ces données sont validées chez la femme ménopausée [
9] et chez l’homme [
10]. À l’inverse, une étude de cas a permis d’obtenir une réduction de l’excrétion urinaire de calcium (de 800 à 113 mg/j) après diminution de la consommation sodée associée à une prescription de 1 g/j de calcium [
11]. L’Afssa (Agence française de sécurité sanitaire des aliments) recommande d’ailleurs de réduire les apports sodés autour de 6 à 8 g/j. La consommation protéique serait le second déterminant majeur de la fuite de calcium. Ainsi, un apport excessif de protéines (s’il n’est pas compensé par des éléments alcalinisants, ce qui est le cas des produits animaux) pourrait entraîner une augmentation de l’excrétion rénale de calcium et, via le métabolisme des acides aminés soufrés qu’elles contiennent, produire une charge acide qui serait tamponnée par le tissu osseux, avec libération de calcium et de bicarbonates se traduisant, à terme, par des effets délétères au niveau osseux [
12]. La perte calcique deviendrait significative avec des apports protéiques quotidiens de l’ordre de 1,2 g/kg, et tout doublement de l’ingestion protéique induirait une augmentation de 50 % de l’excrétion minérale (l’apport conseillé pour les personnes âgées étant de 1 g/kg/j). Les produits végétaux permettraient d’éviter la déminéralisation progressive du squelette en raison de leur forte teneur en sels organiques de potassium métabolisés en bicarbonates [
13]. Il faut cependant distinguer les problèmes d’apports protéiques chez les adultes (qui ont en majorité une consommation adéquate, voire élevée) de ceux des personnes âgées, où la carence protéique est fréquente, notamment chez ceux qui sont victimes de fractures [
14]. Limiter le processus de résorption osseuse grâce à des nutriments protecteurs Le principal facteur impliqué dans la genèse de l’ostéoporose est la carence œstrogénique consécutive à la ménopause. Si un impact est démontré directement au niveau osseux (existence de récepteurs), la restriction hormonale est aussi associée à l’apparition d’une inflammation chronique et d’un stress oxydant. Ce concept est à la base de la théorie cellulaire de l’ostéoporose de B.A. Watkins et al. [
15], selon laquelle la pathologie, bien que d’origine multifactorielle, pourrait résulter d’une surproduction de cytokines inflammatoires (dont le rôle sur la résorption ostéoclastique est avéré) associée une production accrue de radicaux libres, impliqués dans l’étiologie de l’ostéoporose [
16]. Il est probablement possible d’apporter une solution nutritionnelle à ce problème. Les végétaux sont une source de micronutriments dotés de propriétés particulières, tels que les phyto-œstrogènes, dont le potentiel thérapeutique apparaît intéressant dans l’ostéoporose postménopausique, car ils sont riches en molécules anti-oxydantes ou anti-inflammatoires. Les phyto-œstrogènes Les phyto-œstrogènes sont des molécules végétales dotées de propriétés synergiques ou antagonistes des œstrogènes endogènes, en raison d’analogies structurales avec l’œstradiol. Bien que l’ostéoporose soit relativement répandue, son incidence varie selon les pays, les populations asiatiques étant moins exposées. Une relation entre le niveau de consommation de soja et la densité minérale osseuse a été établie [
17]. Ainsi, une stabilisation, voire une amélioration modérée, ont été observées après consommation de protéines de soja [
18–
21], voire de molécules de phyto-œstrogènes (la génistéine, en l’occurrence, à raison de 54 mg/j pendant un an) [
22]. L’expérimentation animale a permis de souligner l’efficacité de différentes molécules et d’établir qu’une intervention préventive devrait être privilégiée. La consommation de phyto-œstrogènes permettrait donc d’éviter les phénomènes de déminéralisation engendrés par une carence hormonale [
23,
24]. En revanche, leur impact sur le risque fracturaire n’a jamais été étudié. Les polyphénols Il existe également une distribution géographique marquée des fractures ostéoporotiques au niveau européen, une corrélation pouvant être établie avec la qualité des régimes nutritionnels et, notamment, l’apport de fruits et légumes (même si de nombreux facteurs confondants peuvent être identifiés), les pays du pourtour méditerranéen, forts consommateurs, étant plus épargnés. Des études épidémiologiques ont permis de corroborer l’impact bénéfique d’une alimentation riche en produits végétaux sur les paramètres de masse osseuse [ 13,
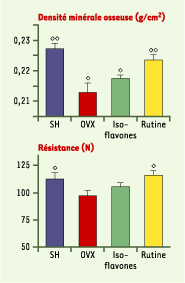
25], différents mécanismes d’action pouvant expliquer ces résultats. En fait, outre leur richesse en sels organiques de potassium, les fruits et légumes constituent une source importante d’anti-oxydants (polyphénols, vitamines C et E, oligo-éléments). À titre d’exemple, la quercétine, un polyphénol de la classe des flavonols, connue pour ses propriétés anti-oxydantes, est capable de préserver les propriétés biomécaniques de fémurs de rates ovariectomisées (modèle expérimental utilisé pour l’étude de l’ostéoporose postménopausique) de façon plus efficace que les isoflavones de soja (Figure 2) [
26].
 | Figure 2.
Influence de la consommation (durant trois mois) de phyto-œstrogènes (isoflavones) ou de polyphénols (rutine : forme glycosylée de la quercétine), à raison de 0,25 % dans le régime, sur la densité minérale et les propriétés biomécaniques de fémurs de rates ovariectomisées. Comparaison par rapport à des animaux castrés (OVX) ou pseudo-opérés (SH) recevant un régime alimentaire standard. Un losange : degré de signification p<0,05 par rapport aux animaux OVX ; deux losanges : degré de signification p< 0,01 par rapport aux animaux OCX (d’après [ 26]). |
La consommation de vitamine C, impliquée dans les réactions d’hydroxylation du collagène et surtout la neutralisation des radicaux libres, a permis d’améliorer la masse osseuse dans le cadre de l’étude épidémiologique PEPI [
27]. De même, la vitamine E peut prévenir la perte trabéculaire, préservant ainsi le capital osseux des seniors [
28]. Ainsi, les micronutriments, et en particulier les polyphénols, possèdent un large spectre d’effets biologiques, notamment en évitant les effets délétères des radicaux libres et en inhibant efficacement les processus inflammatoires. Ces composés pourraient représenter une stratégie innovante de prévention nutritionnelle de l’ostéoporose, en particulier de l’ostéoporose sénile. À cela, il faut ajouter un degré supplémentaire de complexité, car les légumes de type feuille sont aussi les principales sources de vitamine K, cofacteur indispensable à la fonctionnalité de l’ostéocalcine, protéine non collagénique majeure du tissu osseux. Les concentrations plasmatiques en vitamine K sont réduites chez les sujets souffrant d’une fracture de la hanche et, inversement, une supplémentation vitaminique permet de restaurer partiellement le statut minéral [
29]. Les lipides Les acides gras essentiels sont à prendre en considération dans l’estimation du statut inflammatoire et radicalaire, car ils sont impliqués dans la régulation de la production de cytokines, et peuvent donc moduler le statut oxydant en contribuant à la production de NO. En fait, les données relatives à l’impact des lipides sur la sphère osseuse restent rares et encore conflictuelles. Il a été constaté, sur un modèle animal, que la carence en acides gras essentiels induit une ostéoporose sévère couplée à une augmentation des calcifications rénales et artérielles, tandis qu’un régime riche en acides gras ω-3 et CLA (acide linoléique conjugué) permet d’accélérer la formation osseuse [
30]. |
Compte tenu de l’importance de l’alimentation dans l’acquisition du capital osseux et sa préservation, des recommandations nutritionnelles adaptées permettraient d’ouvrir la voie d’une prévention ou, en tout état de cause, devraient accompagner toute prescription médicale. Une alimentation équilibrée durant toute la vie permet effectivement de préserver le capital osseux. Si, jusqu’à présent, la prise en charge de l’ostéoporose a été limitée aux apports calciques (en association avec la vitamine D), il semble important d’intégrer dans l’éducation nutritionnelle - dans un souci de respect des grands équilibres alimentaires - les potentialités des autres nutriments (minéraux, oligo-éléments, vitamines, polyphénols et phyto-œstrogènes, lipides, protéines), même si le niveau de preuves de leur efficacité est encore limité. |
Footnotes |
1. Rapport de la Communauté Européenne. Building strong bones and preventing fractures. Summary report on osteoporosis in the European Community. Action for prevention. Bruxelles : Communauté Européenne, 1999. 2. Meunier PJ, Hercberg S. La prévention nutritionnelle de l’ostéoporose. In : Comptes rendus des Entretiens de Bichat Thérapeutique. Paris : Expansion Scientifique Française, 1999. 3. Guéguen L. Calcium. In : Martin A, ed. Apports nutritionnels conseillés pour la population française, 3e ed. Paris : Éditions Tec et Doc, 2001 : 131–40. 4. Heaney RP. Prévention non médicamenteuse de l’ostéoporose : nutrition et exercice physique. In : Meunier PJ, ed. Ostéoporose : progrès dans le diagnostic et la prise en charge. Londres : Martin Dunitz, 1998 : 163–76. 5. Potier De Courcy G. Estimation du statut en vitamines et minéraux de la population française d’après des enquêtes récentes. Cahiers
Nutr Diet 1999; 34 : 77–87. 6. Cruz JA, Moreiras-Varela O, Van Staveren WA, et al. Intake of vitamins and minerals. Eur J Clin Nutr 1991; 45 : 121–38. 7. Chapuy MC, Arlot M, Dubœuf F. Vitamin D3 and calcium to prevent hip fracture. N Engl J Med 1992; 327 : 1637–42. 8. Matkovic V, Ilich JZ, Andon MB. Urinary calcium, sodium, and bone mass of young females. Am J Clin Nutr 1995; 62 : 417–25. 9. Zarkadas M, Gougeon-Reyburn R, Marliss EB, et al. Sodium chloride supplementation and urinary calcium excretion in postmenopausal women. Am J Clin Nutr 1989; 50 : 1088–94. 10. Castenmiller JJ, Mensink RP, Van der Heijden L. The effect of dietary sodium on urinary calcium and potassium excretion in normotensive men with different calcium intakes. Am J Clin Nutr 1985; 41 : 52–60. 11. Palmieri GM, Pitcock JA. Osteoporosis and hypercalciuria secondary to excessive salt ingestion. J Lab Clin Med 1995; 126 : 503. 12. Frassetto LA, Todd KM, Morris RC, et al. Worldwide incidence of hip fracture in elderly women : relation to consumption of animal and vegetal foods. J Gerontol 2000; 55A : M585–92. 13. New SA, Mc Donald HM, Grubb DA, et al. Positive association between net endogenous noncarbonic acid production (NEAP) and bone health : further support for the importance of the skeleton to acid-base balance. Bone 2001; 28 : S94. 14. Bonjour JP, Schurch MA, Rizzoli R. Nutritional aspects of hip fractures. Bone 1996; 18 : 139–44. 15. Watkins BA, Lippman HE, Le Bouteiller LL, et al. Bioactive fatty acids : role in bone biology and bone cell function. Prog Lipid Res 2001; 40 : 125–48. 16. Mody N, Parhami F, Sarafian TA, et al. Oxidative stress modulates osteoblastic differentiation of vascular and bone cells. Free Radic Biol Med 2001; 31 : 509–19. 17. Horiuchi T, Onouchi T, Takahashi M, et al. Effect of soy protein on bone metabolism in postmenopausal Japanese women. Osteoporos Int 2000; 11 : 721–4. 18. Potter SM, Baun JA, Teng H, et al. Soy protein and isoflavones : their effects on blood lipids and bone density in postmenopausal women. Am J Clin Nutr 1998; 68 : 1375–9. 19. Alekel DL, St Germain A, Peterson CT, et al. Isoflavone-rich soy protein isolate attenuates bone loss in the lumbar spine of perimenopausal women. Am J Clin Nutr 2000; 72 : 844–52. 20. Somekawa Y, Chiguchi M, Ishibashi T, et al. Soy intake related to menopausal symptoms, serum lipids, and bone mineral density in postmenopausal Japanese women. Obstet Gynecol 2001; 97 : 109–15. 21. Greendale GA, Fitzgerald G, Huang MH, et al. Soy isoflavones and bone mineral density : results from the study of women’s health across the nation. Am J Epidemiol 2002; 155 : 746–54. 22. Morabito N, Crisafulli A, Vergara C, et al. Effects of genistein and hormone-replacment therapy on bone loss in early postmenopausal women : a randomized double-blind placebocontrolled study. J Bone Min Res 2002; 17 : 1904–12. 23. Branca F. Dietary phyto-estrogens and bone health. Proc Nutr Soc 2003; 62 : 877–87. 24. Setchell KD, Lydeking-Olsen E. Dietary phytoestrogens and their effect on bone : evidence from in
vitro and in
vivo, human observational, and dietary intervention studies. Am
J Clin Nutr 2003; 78 (suppl) : S593S–609. 25. Tucker KL, Hannan MT, Chen H, et al. Potassium, magnesium, and fruit and vegetable intakes are associated with greater bone mineral density in elderly men and women. Am J Clin Nutr 1999; 69 : 727–36. 26. Horcajada-Molteni MN, Coxam V. Flavonols and iodoflavones prevent bone loss in the ovariectomized rat, a model for postmenopausal osteoporosis. In : Burkhardt F, ed. Nutritional aspects of osteoporosis. San Diego, CA : Academic Press, 2001 : 325–40. 27. Hall SL, Greendale GA. The relation of dietary vitamin C intake to bone mineral density : results from the PEPI study. Calcif Tissue Int 1998; 63 : 183–9. 28. Maenpaa PH, Pirhonen A, Pirskanen A, et al. Biochemical indicators related to antioxidant status and bone metabolic activity in Finnish elderly men. Int Vitam Nutr Res 1989; 59 : 14–9. 29. Vermeer C, Knapen MH, Jie KS. Increased vitamin K intake may retard post-menopausal loss of bone mass. In : Burckhardt P, Heaney RP, eds. Nutritional aspects of osteoporosis 94. Rome : Ares-Serono Symposia Publications, 1995 : 367–79. 30. Das UN. Essential fatty acids and osteoporosis. Nutrition 2000; 16 :386–90. |