| |
| Med Sci (Paris). 2004 October; 20(10): 904–908. Published online 2004 October 15. doi: 10.1051/medsci/20042010904.Un modèle amphibian pour l’étude du développement du contrôle de la respiration Olivier Belzile, Édith Simard, Roumiana Gulemetova, Aida Bairam, and Richard Kinkead* Département de Pédiatrie, Université Laval, Centre de recherche, Hôpital Saint-François d’Assise, 10, rue de l’Espinay, Québec, G1L 3L5 Canada |
« S’il fallait tenir compte des services rendus à la science, la grenouille occuperait la première place »
Claude Bernard (1813-1878)
L’émergence de la respiration aérienne fut une étape marquante dans l’évolution des vertébrés. Au fil des millénaires, leur passage du milieu aquatique au milieu aérien plus riche en oxygène leur a permis d’exploiter de nouveaux habitats et a favorisé l’apparition de nouvelles espèces. Malgré la distance phylogénétique entre les premiers amphibiens ayant eu recours à la respiration aérienne et les humains, tous ces groupes doivent contrôler leur niveau de ventilation pulmonaire afin d’assurer l’homéostasie des gaz respiratoires sanguins (O2 et CO2). Le système de contrôle de la ventilation requiert des structures sensorielles périphériques, ainsi que des mécanismes intégrateurs et effecteurs situés dans le système nerveux central. Au cours de l’ontogénie, leur mise en place a lieu de concert avec le développement pulmonaire, selon une séquence précise, afin d’assurer le succès de la transition de la vie « aquatique » au milieu aérien, tant chez l’homme que chez l’amphibien. Chez le fœtus humain, diverses méthodes d’imagerie par ultrasons ont démontré que les premiers mouvements respiratoires peuvent être détectés dès la 11e semaine de gestation [
1,
2]. À ce stade, les mouvements respiratoires fœtaux sont irréguliers et épisodiques. Bien qu’ils ne participent aucunement aux échanges gazeux, ces mouvements respiratoires contribuent au développement pulmonaire et au façonnement des connexions synaptiques qui constitueront les circuits respiratoires. La fréquence des mouvements respiratoires fœtaux augmentera au cours de la gestation et deviendra continue et rythmique à la naissance [1–
3]. Par conséquent, le profil respiratoire d’un prématuré sera souvent épisodique, et l’importance de cette irrégularité sera déterminée par l’âge auquel le développement in utero est interrompu. |
Approches expérimentales en neurobiologie respiratoire du développement Une proportion importante des progrès scientifiques est attribuable aux nombreuses recherches effectuées sur des mammifères. Au cours des dernières décennies, bon nombre de scientifiques ont notamment fait progresser nos connaissances dans le domaine de la neurobiologie respiratoire de façon substantielle en ayant recours à des modèles expérimentaux tels que la souris, le rat, le chat et le mouton. Cependant, les chercheurs utilisant ces modèles doivent faire face à des contraintes tout aussi diverses que complexes : à titre d’exemple, l’enregistrement de l’activité respiratoire in utero chez l’agneau requiert des interventions chirurgicales importantes soutenues par des infrastructures coûteuses. L’étude des circuits nerveux régissant l’activité respiratoire peut aussi être conduite de façon plus directe et à un niveau organisationnel réduit par le biais d’enregistrements électrophysiologiques in vitro sur le tronc cérébral isolé. Cette technique, d’abord développée en 1931 à partir de l’encéphale de poisson rouge [
4], consiste à isoler le tronc cérébral de l’animal pour le placer ensuite dans une chambre d’enregistrement où le tissu baigne dans une solution oxygénée dont la composition ionique et nutritive s’apparente au liquide céphalorachidien. Il est donc possible d’étudier l’activité des neurones respiratoires de façon systématique grâce à des enregistrements intra- ou extracellulaires, selon le type d’étude. Aujourd’hui, beaucoup de chercheurs utilisent le tronc cérébral isolé provenant de rats nouveau-nés [
5]. En revanche, l’absence de perfusion via le réseau vasculaire est un facteur limitant l’intérêt de cette préparation, puisque l’apport en oxygène et l’élimination des déchets métaboliques (CO2/H+) ne s’effectuent que par diffusion. Il est donc possible qu’au fil du temps, la lenteur de cette diffusion provoque une hypoxie et/ou une acidose tissulaire perturbant le fonctionnement des neurones respiratoires. L’activité respiratoire produite par ces préparations demeure toutefois stable pendant plusieurs heures, à condition que le tronc cérébral soit maintenu à une température plus basse que la normale, soit entre 25o et 28o C, et provienne d’animaux nouveau-nés chez lesquels la tolérance des circuits nerveux à l’hypoxie est plus grande. Malgré le raffinement de cette approche (utilisation de tranches, par exemple), bon nombre de ces contraintes demeurent, imposant ainsi la nécessité d’une approche expérimentale alternative et complémentaire. Comme tous les ectothermes, les grenouilles manifestent une tolérance à l’hypoxie et à l’acidose grandement supérieure à celle des rongeurs et ce, quel que soit leur âge. De plus, la température ambiante (~ 20oC) est une température physiologiquement normale chez la grenouille. Par conséquent, la viabilité de l’activité respiratoire produite par les préparations in vitro provenant de Rana catesbeiana est remarquable, puisque celle-ci peut se maintenir pendant plusieurs jours. En bref, la simplicité et la robustesse du système nerveux central de cette espèce permettent la réalisation d’études ne pouvant pas être menées chez les mammifères. Au-delà de ces considérations techniques, les résultats ont démontré que, malgré les différences propres à la mécanique respiratoire, les structures et les principes fondamentaux du contrôle de la respiration ont été conservés au cours de l’évolution. |
Production du rythme respiratoire au cours du développement Le rythme respiratoire des mammifères est produit par un groupe de neurones situé dans le tronc cérébral au niveau du complexe pré-Bötzinger [
6]. Les mécanismes de fonctionnement de ces circuits demeurent un sujet controversé, selon que l’on considère que ces neurones produisent le rythme respiratoire par le biais d’un réseau d’interactions inhibitrices, ou plutôt par l’entremise de leurs propriétés rythmogéniques intrinsèques (pacemaker), ou bien encore selon une combinaison de ces deux hypothèses [
7]. À cet égard, les récentes études in vitro menées sur le tronc cérébral isolé de têtard (Figure 1) ont permis d’effectuer des avancées importantes, puisque ce modèle permet des études électrophysiologiques à tous les stades de développement. Les premiers mouvements destinés à utiliser l’air comme substrat respiratoire apparaissent sporadiquement chez le têtard prémétamorphique : à ce stade, la contribution des poumons en développement au processus respiratoire est encore négligeable. L’activité respiratoire augmentera progressivement à mesure que les branchies disparaîtront lors de la métamorphose [
8,
9]. Les études électrophysiologiques suggèrent que le fonctionnement des neurones produisant le rythme respiratoire subit d’importants changements au cours du développement, progressant d’une action pacemaker vers un processus d’action en réseau requérant l’inhibition synaptique [
10]. Cette transition, bien qu’elle surgisse tôt dans le développement de cet animal, demeure une étape fondamentale de la maturation des circuits respiratoires ; d’ailleurs, elle a aussi été observée chez le fœtus de rats [
11,
12].
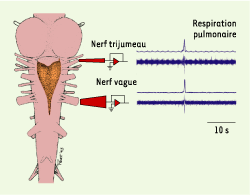
 | Figure 1.
Préparation de tronc cérébral isolé in vitro pour les enregistrements électrophysiologiques de l’activité respiratoire chez Rana catesbeiana. Le cerveau est disséqué et sectionné rostralement devant le tectum optique et caudalement au début de la moelle épinière. Le tronc cérébral est placé dans une chambre d’enregistrement, maintenue à température ambiante, où il baigne dans un tampon oxygéné dont la composition ionique et nutritive est similaire à celle du liquide céphalorachidien. Pour les enregistrements extracellulaires, des électrodes à succion sont placées sur les nerfs crâniens V (trijumeau) et X (vague), dont certaines branches innervent les muscles sollicités dans la production de l’activité respiratoire. Les enregistrements électrophysiologiques présentés illustrent l’activité respiratoire épisodique produite par une préparation provenant d’une grenouille adulte. |
Outre des modifications survenant au sein de l’organisation des neurones responsables du rythme respiratoire, plusieurs familles de neurotransmetteurs (acides aminés, monoamines) modulant cette activité subissent d’importants changements au cours du développement, contribuant ainsi à la maturation du système de contrôle de la respiration [12,
13]. La réorganisation de la neurotransmission inhibitrice GABAergique contribuerait à l’émergence de la respiration aérienne puisque, dans des préparations in vitro provenant de jeunes têtards, l’inactivation pharmacologique des récepteurs GABAB permet d’observer la commande motrice produisant la respiration pulmonaire à des stades précoces où la respiration branchiale prédomine [
14]. Ces résultats suggèrent que les mécanismes amorçant la respiration pulmonaire sont fonctionnels à des stades très jeunes, mais que leur expression dépend du retrait d’une influence inhibitrice dont l’origine demeure encore inconnue [
15]. Notre laboratoire a récemment étudié le rôle de la modulation sérotoninergique sur la maturation de l’activité respiratoire. Nos résultats indiquent que l’effet qu’exerce la sérotonine (5 HT) sur la commande respiratoire varie de façon substantielle au cours du développement [
16,
17]. Dans l’encéphale isolé provenant de têtards prémétamorphiques, l’activation chimique ou électrique du noyau raphé dorsal, qui abrite un des principaux groupes de neurones sérotoninergiques, augmente le nombre de respirations pulmonaires. En revanche, l’activation de ces mêmes neurones dans des préparations provenant d’animaux plus matures a peu d’effet ou inhibe la respiration pulmonaire. Ces résultats suggèrent que la modulation sérotoninergique de l’activité respiratoire s’estompe au cours du développement, au fur et à mesure que la respiration aérienne prend de l’importance [
18]. Il est possible qu’une interaction entre ces deux types de neurotransmission (5-HT et GABA) joue un rôle important dans l’émergence et la maturation de la respiration aérienne. |
La nature épisodique ou intermittente de l’efflux moteur respiratoire est une caractéristique de l’activité produite par le tronc cérébral isolé d’amphibien (Figure 1). Il est important de mentionner que la respiration épisodique ne reflète pas nécessairement un fonctionnement anormal du système de contrôle de la respiration, mais plutôt une propriété fondamentale des circuits respiratoires des vertébrés. Ce profil respiratoire, couramment observé chez les amphibiens et les reptiles, de même que chez certaines espèces de mammifères soumises à des réductions métaboliques importantes (hibernation), répond de façon adéquate à la diminution des besoins d’échanges gazeux [
19,
20]. La respiration épisodique n’est pas un artéfact expérimental, puisque l’encéphale isolé de la grenouille produit une commande respiratoire pratiquement identique au profil observé chez l’animal intact [
21]. La respiration épisodique est aussi observée dans les préparations in vitro provenant de rongeurs au stade fœtal ou nouveau-nés [13]. La similitude entre ce profil de respiration épisodique chez l’amphibien et celui observé chez le nouveau-né prématuré est remarquable (Figure 2) et indique que ce modèle expérimental offre une excellente approche pour l’étude de la respiration épisodique du prématuré, un type d’irrégularité respiratoire pouvant occuper jusqu’à 20 % du temps de sommeil dans cette population [
22]. Les résultats d’études effectuées chez le fœtus d’agneau comme chez la grenouille suggèrent qu’une déficience globale de l’activation des circuits respiratoires est à la base de ce profil respiratoire irrégulier, puisqu’une stimulation accrue par l’hypercapnie (augmentation de la PCO2) donne un profil respiratoire quasi continu où la durée des apnées est grandement réduite [21,
23,
24]. Nos études ont démontré que, chez la grenouille adulte, la région mésencencéphalique de l’isthme joue un rôle critique dans la production du profil respiratoire épisodique. En effet, l’inactivation ou l’ablation chimique de ces neurones a pour résultat un profil respiratoire lent, sans épisodes, peu sensible à l’hypercapnie, et donc comparable à celui observé chez des têtards prémétamorphiques (Figure 3) [
25]. La fonction et le caractère neurophysiologique de ces neurones demeurent inexplorés.
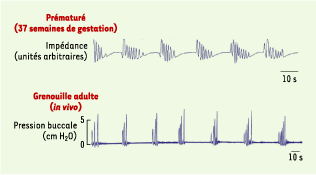
 | Figure 2.
Comparaison entre le profil respiratoire épisodique enregistré chez un prématuré né à 37 semaines de gestation (tracé supérieur) et l’activité enregistrée chez une grenouille adulte. L’activité respiratoire a été enregistrée par impédance dans la cage thoracique chez l’homme ; chez la grenouille, un cathéter a été inséré à l’intérieur de la cavité buccale afin de mesurer les modifications de pression liées à la ventilation pulmonaire. |
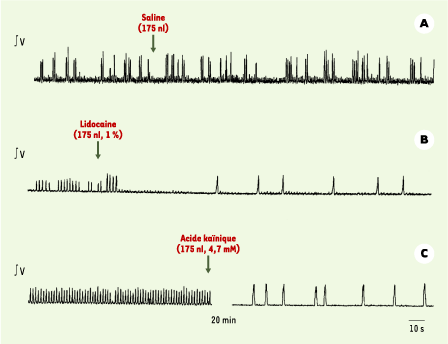
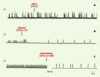 | Figure 3.
Effets de micro-injections bilatérales dans le noyau isthmique sur l’activité respiratoire fictive produite par une grenouille adulte décérébrée, paralysée et artificiellement ventilée. A. Les enregistrements électrophysiologiques de l’activité du nerf trijumeau démontrent que l’injection d’une solution témoin (saline) n’affecte pas l’activité respiratoire (expérience témoin). B. L’enregistrement suivant démontre le changement de fréquence et de profil respiratoire produit par l’inactivation de cette région par le biais de micro-injections bilatérales de lidocaïne dans le noyau isthmique. C. Ces enregistrements présentent l’activité respiratoire avant (gauche) et 20 minutes après (droite) les lésions bilatérales du noyau isthmique par le biais de micro-injections d’acide kaïnique (4,7 mM). Contrairement aux précédents, ces derniers enregistrements ont été obtenus en conditions hypercapniques (3,5 % de CO 2) : ils démontrent que la grenouille produit un profil respiratoire quasi continu lors de l’exposition à un stimulus respiratoire, et que le noyau isthmique entre en jeu dans la détection du CO 2/H+ (d’après [ 25]). |
Les mécanismes responsables de ce profil respiratoire sont peu connus. Toutefois, la neurotransmission GABAergique jouerait un rôle important dans ce type de respiration, car l’activation des récepteurs GABAB par l’application de l’agoniste « baclofen » sur le tronc cérébral isolé convertit un profil respiratoire épisodique en un profil régulier et continu, sans pour autant en changer la fréquence respiratoire [
26]. Chez l’animal entier, un tel changement de profil respiratoire réduirait les oscillations de la PO2 et de la PCO2 artérielles de façon substantielle. Les mécanismes contrôlant l’activation de ce signal GABAergique constituent des pistes de recherche prometteuses. |
À la lumière des récents résultats indiquant que les diverses étapes du développement périnatal des circuits respiratoires des rongeurs sont comparables à celles observées chez Rana catesbeiana, il est clair que les processus neurobiologiques liés à la maturation de ce système homéostatique vital ont été très conservés au cours de l’évolution des vertébrés. Par conséquent, les études effectuées chez les amphibiens devraient contribuer à accroître les connaissances en neurobiologie respiratoire, afin de développer de nouvelles thérapies facilitant la maturation de la commande respiratoire et la réduction de la fréquence des apnées chez les nouveau-nés. |
Nous tenons à remercier le Centre de recherche de l’Hôpital Saint-François d’Assise, la Fondation de la recherche sur les maladies infantiles et le Conseil de recherche en sciences naturelles et en génie (CRSNG) du Canada pour leur soutien financier. Richard Kinkead est titulaire de la chaire de recherche du Canada en neurobiologie respiratoire. L’enregistrement provenant du bébé prématuré présenté dans la Figure 2 a été gracieusement fourni par le Dr Aurore Côté.
|
1. Jansen AH, Chernick V. Development of respiratory control. Physiol Rev 1983; 63 : 437–83. 2. Jansen AH, Chernick V. Foetal breathing and development of control of breathing. J Appl Physiol 1991; 70 : 1431–46. 3. Mortola JP. Respiratory physiology of newborn mammals : a comparative perspective. Baltimore : The Johns Hopkins University Press, 2001 : 344 p. 4. Adrian ED, Buytendijk FJJ. Potential changes in the isolated brain stem of the goldfish. J Physiol (Lond) 1931; 71 : 121–35. 5. Suzue T. Respiratory rhythm generation in the in vitro brain stem-spinal cord preparation of the neonatal rat. J Physiol (Lond) 1984; 354 : 173–83. 6. Smith JC, Ellenberger HH, Ballanyi K, et al. Pre-Botzinger complex : A brainstem region that may generate respiratory rhythm in mammals. Science 1991; 254 : 726–9. 7. Feldman JL. Neural control of breathing. In : Squire LR, Bloom FE, McConnell SK, Roberts JL, Spitzer NC, Zigmond MJ, eds. Fundamental neuroscience. Amsterdam, New York : Academic Press, 2003 : 967–90. 8. Burggren WW, Doyle M. Ontogeny of regulation of gill and lung ventilation in the bullfrog, Rana catesbeiana. Respir Physiol 1986; 66 : 279–91. 9. Burggren WW, Pinder AW. Ontogeny of cardiovascular and respiratory physiology in lower vertebrates. Annu Rev Physiol 1991; 53 : 107–35. 10. Winmill RE, Hedrick MS. Developmental changes in the modulation of respiratory rhythm generation by extracellular K+ in the isolated bullfrog brainstem. J Neurobiol 2003; 55 : 278–7. 11. Di Pasquale E, Monteau R, Hilaire G. Involvement of the rostral ventro-lateral medulla in respiratory rhythm genesis during the peri-natal period : an in vitro study in newborn and foetal rats. Brain Res Dev Brain Res 1994; 78 : 243–52. 12. Hilaire G, Duron B. Maturation of the mammalian respiratory system. Physiol Rev 1999; 79 : 325–60. 13. Viemari JC, Burnet H, Bevengut M, Hilaire G. Perinatal maturation of the mouse respiratory rhythm-generator : in vivo and in vitro studies. Eur J Neurosci 2003; 17 : 1233–44. 14. Straus C, Wilson RJ, Remmers JE. Developmental disinhibition : turning off inhibition turns on breathing in vertebrates. J Neurobiol 2000; 45 : 75–83. 15. Broch L, Morales RD, Sandoval AV, Hedrick MS. Regulation of the respiratory central pattern generator by chloride-dependent inhibition during development in the bullfrog (Rana catesbeiana). J Exp Biol 2002; 205 : 1161–9. 16. Belzile O, Gulemetova R, Kinkead R. Role of 5-HT2A/C receptors in serotonergic modulation of respiratory motor output during tadpole development. Respir Physiol Neurobiol 2002; 133 : 277–82. 17. Kinkead R, Belzile O, Gulemetova R. Serotonergic modulation of respiratory motor output during tadpole development. J Appl Physiol 2002; 93 : 936–46. 18. Belzile O, Gulemetova R, Kinkead R. Stage-dependent effect of raphe neuron stimulation on fictive lung ventilation in Rana catesbeiana : role of 5-HT3 receptors. FASEB J 2003; 17 : A422. 19. Milsom WK. Control and co-ordination of gas exchange in air breathers, chapter 10. Berlin-New York : Springer-Verlag, 1990 : 34–400. 20. Milsom WK. Intermittent breathing in vertebrates. Annu Rev Physiol 1991; 53 : 87–105. 21. Kinkead R, Milsom WK. Chemoreceptors and control of episodic breathing in the bullfrog (Rana catesbeiana). Respir Physiol 1994; 95 : 81–98. 22. Bairam A. Apnea and management. In : Kirpalani H, Moore A, Perlman M, eds. Resident handbook of neonatalogy. New York : Academic Press, 2004 (sous presse). 23. Kianicka I, Diaz V, Dorion D, Praud JP. Coordination between glottic adductor muscle and diaphragm EMG activity in fetal lambs in utero. J Appl Physiol 1998; 84 : 1560–5. 24. Kinkead R, Milsom WK. Role of pulmonary stretch receptor feedback in control of episodic breathing in the bullfrog. Am J Physiol 1997; 272 : R497–508. 25. Kinkead R, Harris MB, Milsom WK. The role of the nucleus isthmi in respiratory pattern formation in bullfrogs. J Exp Biol 1997; 200 : 1781–93. 26. Straus C, Wilson RJ, Tezenas du Montcel S, Remmers JE. Baclofen eliminates cluster lung breathing of the tadpole brainstem, in vitro. Neurosci Lett 2000; 292 : 13–6. |