| |
| Med Sci (Paris). 2004 October; 20(10): 850–851. Published online 2004 October 15. doi: 10.1051/medsci/20042010850.Les Chlamydia, une longue pratique du parasitisme intracellulaire Agathe Subtil* Unité de Biologie des interactions cellulaires, URA CNRS 2582, Institut Pasteur, 25, rue du Docteur Roux, 75015 Paris, France |
Un article récent de M. Horn et al., intitulé Illuminating the evolutionary history of chlamydiae [1], paru dans la revue Science, a certainement porté sous les feux de la rampe une bactérie peu habituée à jouer les premiers rôles. Curieusement, cette bactérie doit cette publicité au séquençage du génome d’une cousine éloignée encore plus obscure, une bactérie de la famille des Parachlamydiaceae, parasite des amibes.
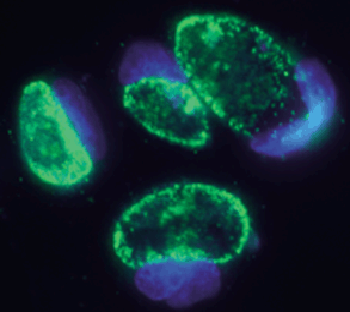
 | Figure 1. Cellules en culture 48 heures après infection par C. trachomatis sérovar D. Les bactéries, marquées en vert, se multiplient à l’intérieur d’un compartiment membranaire jusqu’à occuper presque tout le volume de la cellule hôte, dont le noyau est coloré ici en bleu. |
|
Bouleversements récents chez les ChlamydiaLes bactéries classées dans l’ordre des Chlamydiales ont en commun un cycle de développement très particulier qui se déroule exclusivement à l’intérieur d’une cellule hôte. Longtemps les seuls membres connus de cet ordre furent ceux de la famille des Chlamydiaceae, qui comptent plusieurs espèces pathogènes pour les mammifères et les oiseaux. Les trois espèces pathogènes pour l’homme, C. trachomatis, C. pneumoniae et C. psittaci appartiennent à cette famille. L’infection par C. trachomatis est, dans les pays en voie de développement, responsable du trachome, la première cause infectieuse de cécité. Des bactéries de cette espèce sont également les agents de maladies sexuellement transmissibles très répandues, et l’une des principales causes de stérilité chez la femme. C. pneumoniae est responsable d’infections respiratoires et a été impliquée dans le développement de l’athérosclérose (→). Enfin, pour C. psittaci, parasite des oiseaux, l’homme n’est un hôte que très occasionnel mais son infection peut provoquer une pneumonie sévère. Durant les dix dernières années, la description de bactéries apparentées aux Chlamydiaceae chez des hôtes très divers, en particulier dans des amibes de l’environnement, a bouleversé la classification de ces bactéries et notre perception de leur distribution à la surface du globe [2]. Le séquençage de plusieurs espèces pathogènes de Chlamydia au cours des cinq dernières années a également apporté son lot de surprises, et éclairé certains aspects de la biologie de cet organisme très particulier [3, 4]. Le séquençage de la souche UWE25, une espèce de la famille des Parachlamy-diaceae, parasite des amibes, laissait espérer une meilleure compréhension des capacités métaboliques de ces organismes et de leur adaptation à des niches écologiques très diverses [1]. Mais les conclusions de cette étude n’intéresseront pas uniquement le petit monde des « chlamydiologues ». La découverte, dans le génome de UWE25, d’éléments de virulence connus des espèces de Chlamydia pathogènes, indique que ces éléments étaient présents chez l’ancêtre commun aux Chlamydia environnementales et pathogènes, il y a environ 700 millions d’années [5]. Cet ancêtre pourrait être à l’origine de mécanismes d’exploitation des cellules eucaryotes primitives, mécanismes que l’on retrouve aujourd’hui chez de nombreuses bactéries. (→) m/s 2004, n° 2, p. 169 |
Interagir avec les cellules eucaryotes primitives, il y a plus de 700 millions d’années UWE25 a un peu plus de 900 gènes en commun avec les Chlamydia pathogènes séquencées à ce jour, et près de 1100 gènes supplémentaires. Les espèces pathogènes ont probablement perdu ces gènes parce qu’elles occupent une niche homéostatique, les cellules de vertébrés, tandis que UWE25, parasite de l’amibe, est exposée à des conditions environnementales très fluctuantes. L’analyse comparée des génomes montre en outre que peu d’événements d’acquisition de gènes ont eu lieu après la divergence des Chlamydia environnementales et pathogènes, ce qui signifie que le génome de UWE25 donne probablement un aperçu de ce que fut le génome de leur dernier ancêtre commun, capable d’interagir avec des organismes eucaryotes unicellulaires. Dans ce contexte, la découverte la plus intéressante de l’étude est celle de l’existence d’un appareil de sécrétion de type III chez UWE25. Ce type d’appareil est présent non seulement chez les Chlamydia pathogènes, mais également chez de nombreuses protéobactéries pathogènes telles que shigelles, salmonelles ou encore Pseudomonas syringae, pathogène des plantes. Chez ces bactéries, l’appareil de sécrétion de type III permet d’injecter des protéines bactériennes dans les cellules hôtes, et joue un rôle central dans la virulence [6]. Les gènes codant pour cet appareil sont ordonnés de façon similaire dans les génomes des Chlamydia environnementales et pathogènes, indiquant que leur ancêtre commun possédait déjà ce type d’appareil. À l’inverse, la présence d’un appareil de sécrétion de type IV dans le génome de UWE25 représente probablement une acquisition récente, postérieure à la divergence des deux groupes. En effet, ce type d’appareil est absent des Chlamydia pathogènes, et l’ADN des gènes qui le composent a une composition particulière : son pourcentage en G+C est supérieur à celui de l’ADN du reste du génome de UWE25, indiquant que les gènes codant pour l’appareil de sécrétion de type IV ont été transférés depuis un organisme donneur dont l’ADN présentait un pourcentage élevé en G+C. |
Quels apports pour lutter contre les infections par les Chlamydia ? Outre l’intérêt « évolutif » de cette étude, quels pourraient en être les bénéfices pour les scientifiques, médecins et vétérinaires engagés dans la lutte contre les Chlamydia ? Probablement assez faibles malheureusement, du fait de l’ancienneté de la divergence des deux groupes de Chlamydia. Par exemple, certaines protéines de surface connues des bactéries pathogènes, qui participent probablement à la reconnaissance de l’hôte, n’ont pas été retrouvées chez UWE25. Concernant l’appareil de sécrétion commun à UWE25 et aux Chlamydia pathogènes, il est probable que les effecteurs bactériens qui empruntent cet appareil et sont des éléments essentiels de la virulence sont adaptés aux hôtes avec lesquels chaque espèce interagit. Cependant, la connaissance du génome d’une espèce de Parachlamydia parasite des amibes n’est probablement pas sans intérêt médical, car il a été montré que cette espèce est capable d’infecter des macrophages humains [7], corroborant l’hypothèse selon laquelle même ces cousines éloignées des Chlamydia pathogènes pourraient être impliquées dans des infections respiratoires chez l’homme [8]. |
1. Horn M, Collingro A, Schmitz-Esser S, et al. Illuminating the evolutionary history of chlamydiae. Science 2004; 304 : 728–30. 2. Everett KDE, Bush RM, Andersen AA. Emended description of the order Chlamydiales, proposal of Parachlamydiaceae fam. nov. and Simkaniaceae fam. nov., each containing one monotypic genus, revised taxonomy of the family Chlamydiaceae, including a new genus and five new species and standards for the identification of organisms. Int J Syst Bacteriol 1999; 49 : 415–40. 3. Rockey DD, Lenart J, Stephens RS. Genome sequencing and our understanding of chlamydiae. Infect Immun 2000; 68 : 5473–9. 4. Subtil A, Dautry-Varsat A. Chlamydia : five years A.G. (after genome). Curr Op Microbiol 2004; 7 : 85–92. 5. Greub G, Raoult D. History of the ADP/ATP-translocase-encoding gene, a parasitism gene transferred from a Chlamydiales ancestor to plants 1 billion years ago. Appl Environ Microbiol 2003; 69 : 5530–5. 6. Galan JE, Collmer A. Type III secretion machines : bacterial devices for protein delivery into host cells. Science 1999; 284 : 1322–8. 7. Greub G, Mege JL, Raoult D. Parachlamydia acanthamoebae enters and multiplies within human macrophages and induces their apoptosis. Infect Immun 2003; 71 : 5979–85. 8. Birtles RJ, Rowbotham TJ, Storey C, et al. Chlamydialikeobligate parasite of free-living amoebae. Lancet1997; 349: 925–6. |