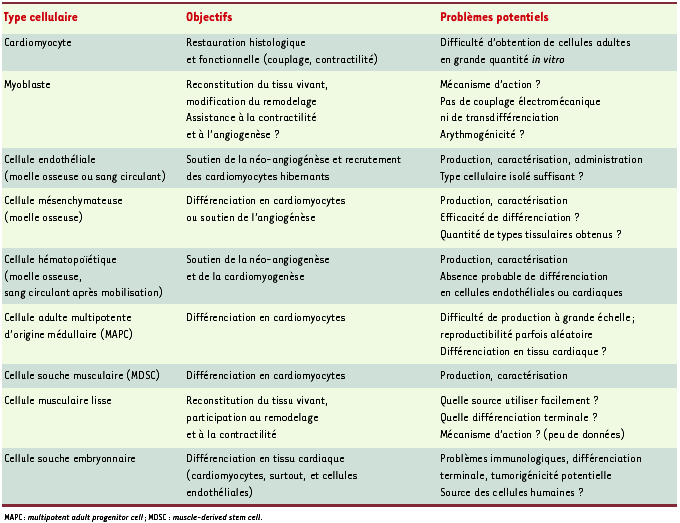
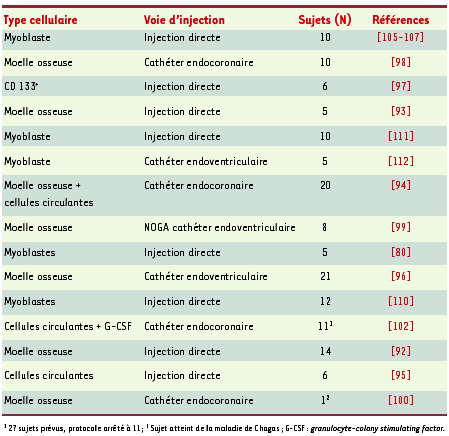
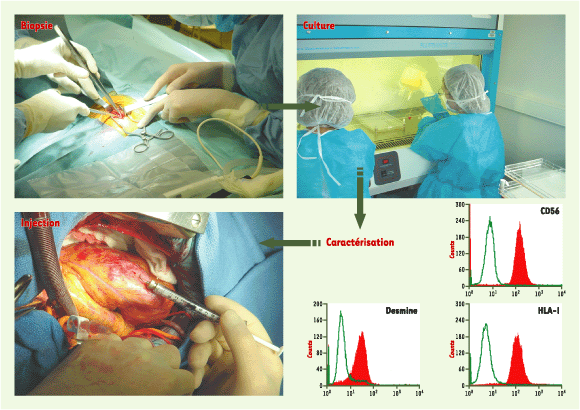
1.
Berry C, Murdoch DR, McMurray JJ. Economics of chronic heart failure. Eur J Heart Fail 2001; 3 : 283–91.
2.
Delahaye F, De Geviney G, Gaillard S, Cheneau E. Epidémiologie et impact économique de l’insuffisance cardiaque en France. Arch Mal Cœur Vaiss 1998; 91 : 1307–14.
3.
Neff AW, Dent AE, Armstrong JB. Heart development and regeneration in urodeles. Int J Dev Biol 1996; 40 : 719–25.
4.
Rose EA, Gelijns AC, Moskowitz AJ, et al. Randomized evaluation of mechanical assistance for the treatment of congestive heart failure (REMATCH) study group. Long-term mechanical left ventricular assistance for end-stage heart failure. N Engl J Med 2001; 345 : 1435–43.
5.
Dowell JD, Rubart M, Pasumarthi KB, et al. Myocyte and myogenic stem cell transplantation in the heart. Cardiovasc Res 2003; 58 : 336–50.
6.
Agbulut O, Menot ML, Li Z, et al. Temporal patterns of bone marrow cell differentiation following transplantation in doxorubicin-induced cardiomyopathy. Cardiovasc Res 2003; 58 : 451–9.
7.
Ishida M, Tomita S, Nakatani T, et al. Bone marrow mononuclear cell transplantation had beneficial effects on doxorubicin-induced cardiomyopathy. J Heart Lung Transplant 2004; 23 : 436–45.
8.
Menasche P. Skeletal muscle satellite cell transplantation. Cardiovasc Res 2003; 58 : 351–7.
9.
Hruban RH, Long PP, Perlman EJ, et al. Fluorescence in situ hybridization for the Y-chromosome can be used to detect cells of recipient origin in allografted hearts following cardiac transplantation. Am J Pathol 1993; 142 : 975–80.
10.
Murry CE, Soonpaa MH, Reinecke H, et al. Haematopoietic stem cells do not transdifferentiate into cardiac myocytes in myocardial infarcts. Nature 2004; 428 : 664–8.
11.
Balsam LB, Wagers AJ, Christensen JL, et al. Haematopoietic stem cells adopt mature haematopoietic fates in ischaemic myocardium. Nature 2004; 428 : 668–73.
12.
Koh GY, Soonpaa MH, Klug MG, et al. Stable fetal cardiomyocytes grafts in the hearts of dystrophic mice and dogs. J Clin Invest 1995; 96 : 2034–42.
13.
Li RK, Jia Z-Q, Weisel RD, et al. Cardiomyocyte transplantation improves heart function. Ann Thorac Surg 1996; 62 : 654–61.
14.
Scorsin M, Hagege A, Marotte F, et al. Does transplantation of cardiomyocytes improve function of infarcted myocardium ? Circulation 1997; 96 : 188–93
15.
Scorsin M, Hagege AA, Vilquin JT, et al. Comparison of the effects of fetal cardiomyocytes and skeletal myoblast transplantation on postinfarct left ventricular function. J Thorac Cardiovasc Surg 2000; 119 : 1169–75.
16.
Reinecke H, Zhang M, Bartosek T, Murry CE. Survival, integration and differentiation of cardiomyocyte grafts : a study in normal and injured rat hearts. Circulation 1999; 100 : 193–202.
17.
Soonpaa MH, Koh GY, Klug MG, Field LJ. Formation of nascent intercalated disks between grafted fetal cardiomyocytes and host myocardium. Science 1994; 264 : 98–101.
18.
Bayes-Genis A, Salido M, Sole Ristol F, et al. Host cell-derived cardiomyocytes in sex-mismatch cardiac allografts. Cardiovasc Res 2002; 56 : 404–10.
19.
Deb A, Wang S, Skelding KA, et al. Bone marrow-derived cardiomyocytes are present in adult human heart: A study of gender-mismatched bone marrow transplantation patients. Circulation 2003; 107 : 1247–9.
20.
Fogt F, Beyser KH, Poremba C, et al. Evaluation of host stem cell-derived cardiac myocytes in consecutive biopsies in long-term cardiac transplant patients. J Heart Lung Transplant 2003; 22 : 1314–7.
21.
Glaser R, Lu MM, Narula N, Epstein JA. Smooth muscle cells, but not myocytes, of host origin in transplanted human hearts. Circulation 2002; 106 : 17–9.
22.
Laflamme M, Myerson D, Saffitx J, Murry CE. Evidence for cardiomyocyte repopulation by extracardiac progenitors in transplanted human hearts. Circ Res 2002; 90 : 634–40.
23.
Quaini F, Urbanek K, Beltrami AP, et al. Chimerism of the transplanted heart. N Engl J Med 2002; 346 : 5–15.
24.
Hierlihy AM, Seale P, Lobe CG, et al. The post-natal heart contains a myocardial stem cell population. FEBS Lett 2002; 530 : 239–43.
25.
Oh H, Bradfute SB, Gallardo TD, et al. Cardiac progenitor cells from adult myocardium : homing, differentiation, and fusion after infarction. Proc Natl Acad Sci USA 2003; 100 : 12313–8.
26.
Cai CL, Liang X, Shi Y, et al. Isl1 identifies a cardiac progenitor population that proliferates prior to differentiation and contributes a majority of cells to the heart. Dev Cell 2003; 5 : 877–89.
27.
Beltrami AP, Barlucchi L, Torella D, et al. Adult cardiac stem cells are multipotent and support myocardial regeneration. Cell 2003; 114 : 763–76.
28.
Nadal-Ginard B, Kajstura J, Leri A, Anversa P. Myocyte death, growth, and regeneration in cardiac hypertrophy and failure. Circ Res 2003; 92 : 139–50.
29.
Sakai T, Ling Y, Payne TR, Huard J. The use of ex vivo gene transfer based on muscle-derived stem cells for cardiovascular medicine. Trends Cardiovasc Med 2002; 12 : 115–20.
30.
Malouf NN, Coleman WB, Grisham JW, et al. Adult-derived stem cells from the liver become myocytes in the heart in vivo. Am J Pathol 2001; 158 : 1929–35.
31.
Hirschi KK, Goodell MA. Hematopoietic, vascular and cardiac fates of bone-marrow derived stem cells. Gene Therapy 2002; 9 : 648–52.
32.
Kamihata H, Matsubara H, Nishiue T, et al. Implantation of bone marrow cells into ischemic myocardium enhances collateral perfusion and regional function via side supply of angioblasts, angiogenic ligands, and cytokines. Circulation 2001; 104 : 1046–52.
33.
Orlic D, Kajstura J, Chimenti S, et al. Bone marrow cells regenerate myocardium. Nature 2001; 410 : 701–5.
34.
Jackson KA, Majka SM, Wang H, et al. Regeneration of ischemic cardiac muscle and vascular endothelium by adult stem cells. J Clin Invest 2001; 107 : 1395–402.
35.
Alvarez-Dolado M, Pardal R, Garcia-Verdugo JM, et al. Fusion of bone-marrow-derived cells with Purkinje neurons, cardiomyocytes and hepatocytes. Nature 2003; 425 : 968–73.
36.
Terada N, Hamazaki T, Oka M, et al. Bone marrow cells adopt the phenotype of other cells by spontaneous cell fusion. Nature 2002; 416 : 542–5.
37.
Wagers AJ, Sherwood RI, Christensen JL, Weissman IL. Little evidence for developmental plasticity of adult hematopoietic stem cells. Science 2002; 297 : 2256–9.
38.
Ying QL, Nichols J, Evans EP, Smith AG. Changing potency by spontaneous fusion. Nature 2002; 416 : 545–8.
39.
Orlic D, Kajstura J, Chimenti S, et al. Mobilized bone marrow cells repair the infarcted heart, improving function and survival. Proc Natl Acad Sci USA 2001; 98 : 10344–9.
40.
Bel A, Messas E, Agbulut O, et al. Transplantation of autologous fresh bone marrow into infarcted myocardium : a word of caution. Circulation 2003; 108 : II247–52.
41.
Norol F, Merlet P, Isnard R, et al. Influence of mobilized stem cells on myocardial infarct repair in a nonhuman primate model. Blood 2003; 102 : 4361–8.
42.
Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells. Science 1999; 284 : 143–7.
43.
Prockop DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues. Science 1997; 276 : 71–4.
44.
Makino S, Fukuda K, Miyoshi S, et al. Cardiomyocytes can be generated from marrow stromal cells in vitro. J Clin Invest 1999; 103 : 697–705.
45.
Toma C, Pittenger MF, Cahill KS, et al. Human mesenchymal stem cells differentiate to a cardiomyocyte phenotype in the adult murine heart. Circulation 2002; 105 : 93–98.
46.
Jiang Y, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature 2002; 418 : 41–9.
47.
Planat-Benard V, Menard C, Andre M, et al. Spontaneous cardiomyocyte differentiation from adipose tissue stroma cells. Circ Res 2004; 94 : 223–9.
48.
Kawamoto A, Gwon HC, Iwaguro H, et al. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia. Circulation 2001; 103 : 634–7.
49.
Kocher AA, Schuster MD, Szabolcs MJ, et al. Neovascularization of ischemic myocardium by human bone-marrow-derived angioblasts prevents cardiomyocyte apoptosis, reduces remodeling and improves cardiac function. Nature Medicine 2001; 7 : 430–6.
50.
Masuda H, Asahara T. Post-natal endothelial progenitor cells for neovascularization in tissue regeneration. Cardiovasc Res 2003; 58 : 390–8.
51.
Tateishi-Yuyama E, Matsubara H, Murohara T, et al. Therapeutic angiogenesis using cell transplantation (Tact) study investigators. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells : a pilot study and a randomised controlled trial. Lancet 2002; 360 : 427–35.
52.
Badorff C, Brandes RP, Popp R, et al. Transdifferentiation of blood-derived human adult endothelial progenitor cells into functionally active cardiomyocytes. Circulation 2003; 107 : 1024–32.
53.
Condorelli G, Borello U, De Angelis L, et al. Cardiomyocytes induce endothelial cells to transdifferentiate into cardiac muscle : implications for myocardium regeneration. Proc Natl Acad Sci USA 2001; 98 : 10733–8.
54.
Etzion S, Battler A, Barbash IM, et al. Influence of embryonic cardiomyocyte transplantation on the progression of heart failure in a rat model of extensive myocardial infarction. J Mol Cell Cardiol 2001; 33 : 1321–30.
55.
Gepstein L. Derivation and potential applications of human embryonic stem cells. Circ Res 2002; 91 : 866–76.
56.
He JQ, Ma Y, Lee Y, et al. Human embryonic stem cells develop into multiple types of cardiac myocytes : action potential characterization. Circ Res 2003; 93 : 32–9.
57.
Kehat I, Kenyagin-Karsenti D, Snir M, et al. Human embryonic stem cells can differentiate into myocytes with structural and functional properties of cardiomyocytes. J Clin Invest 2001; 108 : 407–14.
58.
Klug MG, Soonpaa MH, Koh GY, Field LJ. Genetically selected cardiomyocytes from differentiating embronic stem cells form stable intracardiac grafts. J Clin Invest 1996; 98 : 216–24.
59.
Zhang YM, Hartzell C, Narlow M, Dudley SC Jr. Stem cell-derived cardiomyocytes demonstrate arrhythmic potential. Circulation 2002; 106 : 1294–9.
60.
Li RK, Jia ZQ, Weisel RD, et al. Smooth muscle cell transplantation into myocardial scar tissue improves heart function. J Mol Cell Cardiol 1999; 31 : 513–22.
61.
Yoo KJ, Li RK, Weisel RD, et al. Autologous smooth muscle cell transplantation improved heart function in dilated cardiomyopathy. Ann Thorac Surg 2000; 70 : 859–65.
62.
Mauro A. Satellite cell of skeletal muscle fibers. J Biophys Biochem Cytol 1961; 9 : 493–5.
63.
Skuk D, Roy B, Goulet M, et al. Dystrophin expression in myofibers of Duchenne muscular dystrophy patients following intramuscular injections of normal myogenic cells. Mol Ther 2004; 9 : 475–82.
64.
Koh GY, Klug MG, Soonpaa MH, et al. Differentiation and long-term survival of C2C12 myoblast grafts in heart. J Clin Invest 1993; 92 : 1548–54.
65.
Chiu RC-J, Zibaitis A, Kao RL. Cellular cardiomyoplasty: Myocardial regeneration with satellite cell implantation. Ann Thorac Surg 1995; 60 : 12–8.
66.
Marelli D, Desrosiers C, el-Alfy M, et al. Cell transplantation for myocardial repair : an experimental approach. Cell Transplant 1992; 1 : 383–90.
67.
Murry CE, Wiseman RW, Schwartz SM, et al. Skeletal myoblast transplantation for repair of myocardial necrosis. J Clin Invest 1996; 98 : 2512–23.
68.
Pouzet B, Vilquin J-T, Hagege AA, et al. Factors affecting functional outcome following autologous skeletal myoblast transplantation. Ann Thorac Surg 2001; 71 : 844–50.
69.
Pouzet B, Vilquin J-T, Hagege AA, et al. Intramyocardial transplantation of autologous myoblasts: can tissue processing be optimized ? Circulation 2000; 102 : III-210–5.
70.
Rajnoch C, Chachques JC, Berrebi A, et al. Cellular therapy reverses myocardial dysfunction. J Thorac Cardiovasc Surg 2001; 121 : 871–8.
71.
Taylor DA, Atkins BZ, Hungspreugs P, et al. Regenerating functional myocardium : improved performance after skeletal myoblast transplantation. Nature Medecine 1998; 4 : 929–33.
72.
Al Attar N, Carrion C, Ghostine S, et al. Long-term (1 year) functional and histological results of autologous skeletal muscle cells transplantation in rat. Cardiovasc Res 2003; 58 : 142–8.
73.
Ghostine S, Carrion C, Souza LC, et al. Long-term efficacy of myoblast transplantation on regional structure and function after myocardial infarction. Circulation 2002;106 : I-131–6.
74.
Jain M, DerSimonian H, Brenner DA, et al. Cell therapy attenuates deleterious ventricular remodeling and improves cardiac performance after myocardial infarction. Circulation 2001; 103 : 1920–7.
75.
Pouzet B, Ghostine S, Vilquin JT, et al. Is skeletal myoblast transplantation clinically relevant in the era of angiotensin-converting enzyme inhibitors ? Circulation 2001; 104 : I-223–88.
76.
Reinecke H, Poppa V, Murry CE. Skeletal muscle stem cells do not transdifferentiate into cardiomyocytes after cardiac grafting. J Mol Cell Cardiol 2002; 34 : 241–9.
77.
Reinecke H, Minami E, Poppa V, Murry CE. Evidence for fusion between cardiac and skeletal muscle cells. Circ Res 2004; 94 : e56–60.
78.
Léobon B, Garcin I, Menasche P, et al. Myoblasts transplanted into rat infarcted myocardium are functionally isolated from their host. Proc Natl Acad Sci USA 2003; 100 : 7808–11.
79.
Reinecke H, MacDonald GH, Hauschka SD, Murry CE. Electromechanical coupling between skeletal and cardiac muscle. Implications for infarct repair. J Cell Biol 2000; 149 : 731–40.
80.
Pagani FD, DerSimonian H, Zawadzka A, et al. Autologous skeletal myoblasts transplanted to ischemia-damaged myocardium in humans. Histological analysis of cell survival and differentiation. J Am Coll Cardiol 2003; 41 : 879–88.
81.
Redaelli G, Malhotra A, Li B, et al. Effects of constitutive overexpression of insulin-like growth factor-1 on the mechanical characteristics and molecular properties of ventricular myocytes. Circ Res 1998; 82 : 594–603.
82.
Ohno N, Fedak PW, Weisel RD, et al. Transplantation of cryopreserved muscle cells in dilated cardiomyopathy : effects on left ventricular geometry and function. J Thorac Cardiovasc Surg 2003; 126 : 1537–48.
83.
Fujii T, Yau TM, Weisel RD, et al. Cell transplantation to prevent heart failure: A comparison of cell types. Ann Thorac Surg 2003; 76 : 2062–70
84.
Hutcheson KA, Atkins BZ, Hueman MT, et al. Comparison of benefits on myocardial performance of cellular cardiomyoplasty with skeletal myoblasts and fibroblasts. Cell Transplant 2000; 9 : 359–68.
85.
Thompson RB, Emani SM, Davis BH, et al. Comparison of intracardiac cell transplantation: autologous skeletal myoblasts versus bone marrow cells. Circulation 2003; 108 : II264–71.
86.
Suzuki K, Murtuza B, Heslop L, et al. Single fibers of skeletal muscle as a novel graft for cell transplantation to the heart. J Thorac Cardiovasc Surg 2002; 123 : 984–92.
87.
Borenstein N, Bruneval P, Hekmati M, et al. Noncultured, autologous, skeletal muscle cells can successfully engraft into ovine myocardium. Circulation 2003; 107 : 3088–92.
88.
Kornowski R, Fuchs S, Leon MB, Epstein SE. Delivery strategies to achieve therapeutic myocardial angiogenesis. Circulation 2000; 101 : 454–8.
89.
Chazaud B, Hittinger L, Sonnet C, et al. Endoventricular porcine autologous myoblast transplantation can be successfully achieved with minor mechanical cell damage. Cardiovasc Res 2003; 58 : 444–50.
90.
Garot J, Unterseeh T, Teiger E, et al. Magnetic resonance imaging of targeted catheter-based implantation of myogenic precursor cells into infarcted left ventricular myocardium. J Am Coll Cardiol 2003; 41 : 1841–6.
91.
Fuchs S, Satler LF, Kornowski R, et al. Catheter-based autologous bone marrow myocardial injection in no-option patients with advanced coronary artery disease: A feasibility study. J Am Coll Cardiol 2003; 41 : 1721–4.
92.
Galinanes M, Loubani M, Davies J, et al. Autotransplantation of unmanipulated bone marrow into scarred myocardium is safe and enhances cardiac function in humans. Cell Transplant 2004; 13 : 7–13.
93.
Hamano K, Nishida M, Hirata K, et al. Local implantation of autologous bone marrow cells for therapeutic angiogenesis in patients with ischemic heart disease: Clinical trial and preliminary results. Jpn Circ J 2001; 65 : 845–7.
94.
Assmus B, Schachinger V, Teupe C, et al. Transplantation of progenitor cells and regeneration enhancement in acute myocardial infarction (Topcare-Ami). Circulation 2002; 106 : 3009–17.
95.
Ozbaran M, Omay SB, Nalbantgil S, et al. Autologous peripheral stem cell transplantation in patients with congestive heart failure due to ischemic heart disease. Eur J Cardiothorac Surg 2004; 25 : 342–50
96.
Perin EC, Dohmann HF, Borojevic R, et al. Transendocardial, autologous bone marrow cell transplantation for severe, chronic ischemic heart failure. Circulation 2003; 107 : 2294–302.
97.
Stamm C, Westphal B, Kleine HD, et al. Autologous bone-marrow stem-cell transplantation for myocardial regeneration. Lancet 2003; 361 : 45–6.
98.
Strauer BE, Brehm M, Zeus T, et al. Repair of infarcted myocardium by autologous intracoronary mononuclear bone marrow cell transplantation in humans. Circulation 2002; 106 : 1913–8.
99.
Tse HF, Kwong YL, Chan JK, et al. Angiogenesis in ischaemic myocardium by intramyocardial autologous bone marrow mononuclear cell implantation. Lancet 2003; 361 : 47–9.
100.
Vilas-Boas F, Feitosa GS, Soares MB, et al. Bone marrow cell transplantation to the myocardium of a patient with heart failure due to Chagas’ disease. Arq Bras Cardiol 2004; 82 : 185-7, 181–4.
101.
Matsubara H. Risk to the coronary arteries of intracoronary stem cell infusion and G-CSF cytokine therapy. Lancet 2004; 363 : 746–7.
102.
Kang HJ, Kim HS, Zhang SY, et al. Effects of intracoronary infusion of peripheral blood stem-cells mobilised with granulocyte-colony stimulating factor on left ventricular systolic function and restenosis after coronary stenting in myocardial infarction : the MAGIC cell randomised clinical trial. Lancet 2004; 363 : 751–6.
103.
Silvestre JS, Gojova A, Brun V, et al. Transplantation of bone marrow-derived mononuclear cells in ischemic apolipoprotein E-knockout mice accelerates atherosclerosis without altering plaque composition. Circulation 2003; 108 : 2839–42.
104.
Vulliet PR, Greeley M, Halloran SM, et al. Intra-coronary arterial injection of mesenchymal stromal cells and microinfarction in dogs. Lancet 2004; 363 : 783–4.
105.
Menasché P, Hagège AA, Scorsin M, et al. First successful clinical myoblast transplantation for heart failure. Lancet 2001; 357 : 279–80.
106.
Menasché P, Hagege AA, Vilquin JT, et al. Autologous skeletal myoblast transplantation for severe postinfarction left ventricular dysfunction. J Am Coll Cardiol 2003; 41 : 1078–83.
107.
Hagège AA, Carrion C, Menasche P, et al. Viability and differentiation of autologous skeletal myoblast grafts in ischaemic cardiomyopathy. Lancet 2003; 361 : 491–2.
108.
Argenziano M, Spotnitz HM, Whang W, et al. Risk stratification for coronary bypass surgery in patients with left ventricular dysfunction : analysis of the coronary artery bypass grafting patch trial database. Circulation 1999; 100 : II119–24.
109.
Steinberg JS, Gaur A, Sciacca R, Tan E. New-onset sustained ventricular tachycardia after cardiac surgery. Circulation 1999; 99 : 903–8.
110.
Herreros J, Prosper F, Perez A, et al. Autologous intramyocardial injection of cultured skeletal muscle-derived stem cells in patients with non-acute myocardial infarction. Eur Heart J 2003; 24 : 2012–20.
111.
Siminiak T, Kalawski R, Kurpisz M. Myoblast transplantation in the treatment of postinfarction myocardial contractility impairment. A case report. Polish Heart Journal 2002; 56 : 131–5.
112.
Smits PC, van Geuns RJ, Poldermans D, et al. Catheter-based intramyocardial injection of autologous skeletal myoblasts as a primary treatment of ischemic heart failure: clinical experience with six-month follow-up. J Am Coll Cardiol 2003; 42 : 2063–9.
113.
Suzuki K, Murtuza B, Smolenski RT, Yacoub MH. Selective cell dissemination into the heart by retrograde intracoronary infusion in the rat. Transplantation 2004; 77 : 757–9.
114.
Thompson CA, Nasseri BA, Makower J, et al. Percutaneous transvenous cellular cardiomyoplasty. A novel nonsurgical approach for myocardial cell transplantation. J Am Coll Cardiol 2003; 41 : 1964–71.
115.
Skuk D, Goulet M, Roy B, Tremblay JP. Efficacy of myoblast transplantation in nonhuman primates following simple intramuscular cell injections : toward defining strategies applicable to humans. Exp Neurol 2002; 175 : 112–26.
116.
El Fahime E, Torrente Y, Caron NJ, et al. In vivo migration of transplanted myoblasts requires matrix metalloproteinase activity. Exp Cell Res 2000; 258 : 279–87.
117.
Ito H, Hallauer PL, Hastings KE, Tremblay JP. Prior culture with concanavalin A increases intramuscular migration of transplanted myoblast. Muscle Nerve 1998; 21 : 291–7.
118.
Beauchamp JR, Pagel CN, Partridge TA. A dual-marker system for quantitative studies of myoblast transplantation in the mouse. Transplantation 1997; 63 : 1794–7.
119.
Huwer H, Winning J, Vollmar B, et al. Long-term cell survival and hemodynamic improvements after neonatal cardiomyocyte and satellite cell transplantation into healed myocardial cryoinfarcted lesions in rats. Cell Transplant 2003;12 : 757–67.
120.
Muller-Ehmsen J, Whittaker P, Kloner RA, et al. Survival and development of neonatal rat cardiomyocytes transplanted into adult myocardium. J Mol Cell Cardiol 2002; 34 : 107–16.
121.
Reinecke H, Murry CE. Taking the death toll after cardiomyocyte grafting: a reminder of the importance of quantitative biology. J Mol Cell Cardiol 2002; 34 : 251–3.
122.
Skuk D, Caron NJ, Goulet M, et al. Resetting the problem of cell death following muscle-derived cell transplantation: detection, dynamics and mechanisms. J Neuropathol Exp Neurol 2003; 62 : 951–67.
123.
Zhang M, Methot D, Poppa V, et al. Cardiomyocyte grafting for cardiac repair : graft cell death and anti-death strategies. J Mol Cell Cardiol 2001; 33 : 907–21.
124.
Guérette B, Skuk D, Celestin F, et al. Prevention by anti-LFA-1 of acute myoblast death following transplantation. J Immunol 1997; 159 : 2522–31.
125.
Suzuki K, Smolenski RT, Jayakumar J, et al. Heat shock treatment enhances graft cell survival in skeletal myoblast transplantation to the heart. Circulation 2000; 102 : III216–21.
126.
Zimmermann WH, Melnychenko I, Eschenhagen T. Engineered heart tissue for regeneration of diseased hearts. Biomaterials 2004; 25 : 1639–47.
127.
Murtuza B, Suzuki K, Bou-Gharios G, et al. Transplantation of skeletal myoblasts secreting an IL-1 inhibitor modulates adverse remodeling in infarcted murine myocardium. Proc Natl Acad Sci USA 2004; 101 : 4216–21.
128.
Retuerto MA, Schalch P, Patejunas G, et al. Angiogenic pretreatment improves the efficacy of cellular cardiomyoplasty performed with fetal cardiomyocyte implantation. J Thorac Cardiovasc Surg 2004; 127 : 1041–50.
129.
Suzuki K, Murtuza B, Smolenski RT, et al. Cell transplantation for the treatment of acute myocardial infarction using vascular endothelial growth factor-expressing skeletal myoblasts. Circulation 2001; 104 : I207–12.