| |
| Med Sci (Paris). 2004 May; 20(5): 593–598. Published online 2004 May 15. doi: 10.1051/medsci/2004205593.Épidémie de sida en Afrique subsaharienne Xavier Anglaret* and Roger Salamon Inserm U.593, Universite Victor Segalen Bordeaux 2, 146, rue Léo Saignat, 33076 Bordeaux Cedex, France |
Entre 1994 et 2002, le nombre de personnes vivant avec le VIH dans le monde a triplé. La progression est contenue dans les pays industrialisés, même si des inquiétudes récentes montrent que la bataille n’est jamais gagnée. La progression est en revanche constante en Afrique subsaharienne, qui accueille actuellement 13 % de la population mondiale, mais 70 % des 42 millions d’adultes et d’enfants vivant avec le VIH dans le monde [
1]. Avec un PNB (produit national brut) moyen par habitant 65 fois inférieur à celui des pays d’Europe de l’ouest et d’Amérique du Nord, l’Afrique subsaharienne doit aujourd’hui faire face à une prévalence moyenne du VIH 18 fois supérieure. Il n’est pas étonnant que cette situation ait non seulement des conséquences sanitaires, démographiques, sociales, économiques et politiques désastreuses, et sans cesse revues à la hausse, mais aussi que le constat en termes de protection contre les nouvelles infections et de niveau de prise en charge des personnes atteintes soit globalement pessimiste. En 1996, sont apparues les multithérapies antirétrovirales qui ont révolutionné le pronostic vital des personnes infectées dans les pays industrialisés ; en revanche, l’Onusida estimait fin 2001 que seulement 0,1 % des personnes vivant avec le VIH en Afrique subsaharienne en avaient bénéficié [
2]. Il n’est pas utile de multiplier les chiffres sur l’épidémie et sur ses conséquences, facilement disponibles dans leur moindre détails et dans leurs versions actualisées dans les rapports de l’Onusida et dans de nombreuses autres publications [
3]. Les mesures efficaces pour lutter contre le VIH en Afrique subsaharienne n’étant pas toujours extrapolables à partir des connaissances issues des pays industrialisés, il nous a en revanche paru utile d’insister sur les spécificités de l’épidémie africaine en termes d’épidémiologie, d’histoire naturelle, d’interventions validées et enfin de questions de recherches restant à explorer. |
Spécificité épidémiologique de l’infection par le VIH en Afrique subsaharienne Fin 2002, la prévalence moyenne de l’infection par le VIH chez l’adulte en Afrique subsaharienne était estimée à 8,8 % [1]. Cette moyenne cache de très fortes disparités entre les pays (de moins de 1 % au Sénégal à plus de 38 % au Zimbabwe). L’évolution montre malheureusement que le pire de l’épidémie est encore à venir. Les quelques pays où la prévalence baisse (Ouganda) ou reste faible sans augmenter (Sénégal, Mali) donnent des signes d’espoir faibles par rapport aux signes pessimistes en provenance des nombreux pays où la prévalence reste élevée de façon stable, voire augmente de façon parfois foudroyante. En dehors du continent africain, et hormis quelques zones des Caraïbes, la prévalence moyenne de l’infection par le VIH dans le monde ne dépasse pas 5 %. Pour expliquer la spécificité de l’ampleur de l’épidémie en Afrique, de nombreuses hypothèses plus ou moins sérieuses ont été formulées, incluant des tentatives d’explications chronologiques, virales, comportementales ou encore socioéconomiques. Aucune n’emporte seule la conviction et leur enchaînement, en potentialisant leurs effets, n’apporte sans doute qu’une part de la réponse [
4]. Des explications de différente nature Sur un plan chronologique, l’épidémie est objectivement plus ancienne en Afrique qu’ailleurs : le plus ancien des plasmas séropositifs au VIH-1 connu, datant de 1959, appartenait à un habitant du Congo démocratique [
5] ; par ailleurs, des études phylogénétiques situent l’origine du virus en Afrique centrale, dans les années 1930 [
6]. Cependant, la plupart des auteurs se rejoignent pour dater le début de l’épidémie en Afrique dans les années 1970, ce qui n’est pas très éloigné des dates de début de l’épidémie dans d’autres régions du monde telles que l’Europe ou l’Amérique du Nord [
7]. Sur un plan virologique, l’épidémiologie moléculaire révèle un certain nombre de spécificités en Afrique, dont l’importance des souches VIH-2 dans certaines zones et la très grande diversité génétique des souches de VIH-1 [
8]. Aucune connaissance actuelle ne suggère cependant que cette diversité, qui a son importance en matière de recherche vaccinale, ait participé au différentiel de prévalence si important entre l’Afrique et les autres continents. Sur un plan comportemental, il existe des différences notables de modes de contamination dominants entre l’Afrique et les pays occidentaux. En Afrique, le mode quasi exclusif de contamination est hétérosexuel, et près de 60 % des adultes infectés sont actuellement des femmes. Le statut de la femme, plus volontiers qu’ailleurs l’objet - dans les pays en développement - de discrimination sociale (accès à l’éducation, à l’emploi…) et d’une certaine subordination en matière de rapports sexuels, l’expose malheureusement plus fortement aux risques de contamination. Mis à part ce fait, qui rejoint le groupes des facteurs explicatifs « socioéconomiques », il n’existe aucun « comportement africain spécifique » expliquant une épidémie plus forte ici qu’ailleurs. Enfin, sur un plan socioéconomique, la pauvreté, l’urbanisation excessive ou trop rapide, et bien sûr les conflits sont des facteurs favorisant le développement de l’infection, quelle que soit la région du monde. Il ne s’agit pas simplement du constat habituellement porté, et avec justesse, que la pauvreté quelle qu’en soit son acception (matérielle, physique, morale ou sociale) favorise toute morbidité. Il s’agit ici d’une relation épidémiologique très directe, de nature causale, entre une situation socioéconomique effondrée et une maladie virale qui bénéficie alors d’une facilitation pour son extension et d’une diminution dans les moyens (de prévention et de traitement) qui pourraient l’enrayer. Une spécificité également intrarégionale La situation semble encore plus complexe quand on constate que cette forte différence d’intensité de l’épidémie entre l’Afrique subsaharienne et le reste du monde s’accompagne, à l’intérieur même du continent africain, de fortes disparités entre les différents pays. Pour illustrer cela, le meilleur indicateur est sans doute la prévalence de l’infection chez les femmes reçues en consultation prénatale en zone urbaine (CPNU) ; non que celles-ci soient représentatives de la population des femmes des pays dont elles sont issues, mais parce que ces données présentent un minimum de biais, ce qui permet leur comparaison. Les données de prévalence en CPNU issues du rapport 2002 de l’Onusida [ 3] ( Tableau I) montrent qu’il existe aujourd’hui un gradient décroissant partant du sud de l’Afrique pour remonter vers l’ouest, en passant par une zone englobant le centre et l’est. Cette hétérogénéité n’a pas toujours eu le même profil, les pays d’Afrique centrale où la prévalence dans les années 1980 était originellement la plus élevée ayant vu, au début des années 1990, leur chiffre rester à peu près stable, pendant que l’épidémie explosait en Afrique de l’Est et du Sud [ 4]. Là encore, ni les comportements sexuels, ni les sous-types de virus circulants n’expliquent de façon forte cette hétérogénéité à l’intérieur du continent. On insiste souvent à juste titre (et de manière presque « conjuratoire ») sur les différences de mobilisation politique, associative, voire religieuse mise en œuvre pour lutter précocement et de façon conjointe contre le développement d’une épidémie qui n’a pas encore explosé dans un pays donné. Un récent travail multidisciplinaire international a en fait très bien illustré la complexité de l’intrication des nombreux facteurs qui doivent s’associer pour expliquer le phénomène, en montrant notamment le rôle interdépendant des facteurs liés au comportement sexuel, par exemple l’âge des jeunes femmes et le différentiel d’âge avec leur partenaire [
9].
 | Tableau I.
Prévalences (médianes) de l’infection par le VIH (données Onusida, 2002) chez les femmes d’Afrique subsaharienne reçues en consultation prénatale des zones urbaines (CPNU).
|
|
Connaître l’histoire naturelle de la maladie pour mieux la prendre en charge Avant l’avènement des multithérapies antirétrovirales, le diagnostic et le traitement des maladies du stade sida dans les pays industrialisés mobilisaient des moyens sophistiqués pour des gains faibles en terme de survie. De leur côté, les pays en développement se voyaient conseiller soit d’investir dans la prévention de l’infection, soit de réserver les moyens disponibles à des interventions de meilleurs rapports coût-efficacité s’appliquant à des pathologies autres que celle à VIH [
10]. Ces conseils ignoraient deux réalités. D’une part, dans les populations urbaines où plus de 10 % des adultes étaient infectés par le VIH, la prévalence dépassait 20 % dans les centres de soins primaires et 50 % dans les grands services hospitaliers [
11,
12]. Dans les pays industrialisés, une personne hospitalisée ou se présentant en consultation avec des symptômes invalidants et non spontanément résolutifs ne s’entend jamais répondre qu’elle est porteuse d’une affection pour laquelle il n’existe aucune « intervention acceptable en termes de rapport coût-efficacité » : elle fait l’objet d’une prise en charge. D’autre part, un clinicien confronté à une personne malade se pose toujours la question de savoir quels sont les soins les plus efficaces parmi ceux qu’il est en mesure de proposer. La réponse gagne toujours à s’appuyer sur des études cliniques réalisées dans le contexte où se pose la question. Une histoire naturelle spécifique à l’Afrique La majorité des études documentant la morbidité liée à l’infection par le VIH chez l’adulte en Afrique subsaharienne ont d’abord été transversales, en milieu hospitalier et sur des personnes à un stade d’immunodépression avancé [
13–
27]. En vingt ans, une seule étude autopsique d’envergure de causes de mortalité a été réalisée sur le continent [
28], et les études prospectives en milieu extrahospitalier comportant des données détaillées de causes de morbidité plus précoces dépassent à peine la dizaine. La quasi-totalité de ces études prospectives s’attachaient à décrire une seule pathologie (principalement la tuberculose et les infections à pneumocoque) [
29–
34]. Les quelques cohortes africaines comportant un suivi à long terme sont des études épidémiologiques décrivant la mortalité ou la survie sans sida, la morbidité y étant succinctement décrite sous forme de symptômes (diarrhée, amaigrissement…) [
35–
38]. Malgré leur grande hétérogénéité et leur réalisation en trop faible nombre, ces études cliniques ont progressivement dessiné un spectre des infections opportunistes rompant avec l’image du sida que véhiculaient les connaissances issues des pays industrialisés. Chez l’adulte, elles ont permis de différencier schématiquement deux phases dans la maladie liée au VIH (Figure 1). On distingue ainsi une phase précoce, commençant avec l’apparition d’un risque significatif de maladies mortelles non opportunistes au sens strict, mais d’incidence croissante avec l’immunodépression : tuberculose, maladies bactériennes et paludisme [
23,
25, 28, 34,
39–
41]. En Afrique subsaharienne, ces trois maladies occupent dans cet ordre les premiers rang des affections liées au VIH. Même si elles sont plus souvent retrouvées en association avec le VIH, elles ont la particularité d’être également des causes fréquentes de morbidité dans la population générale. Elles sont souvent vues dans le cadre de centre de soins de premiers recours, où la question d’un traitement adapté à leurs spécificités en association avec le VIH au milieu d’une prise en charge type « population générale » peut poser des problèmes plus complexes qu’il n’y paraît. Dans une seconde phase, plus tardive, le risque de développer une de ces trois maladies persiste, mais s’y rajoute un risque croissant d’infections opportunistes « classiques » du stade C de la classification des CDC (centers for control disease and prevention). Parmi ces dernières, certaines comme la pneumocystose sont clairement moins fréquentes en Afrique subsaharienne que ce que connaissaient les pays industrialisés [
14, 28] ; d’autres ont des fréquences globalement plus élevées (isposporose, par exemple) ou identiques (toxoplamose, mycobactérioses atypiques), mais pouvant varier suivant les pays (toxoplamose) ; d’autres encore ont une place encore mal définie (pathologie invasive à cytomégalovirus, lymphomes…).
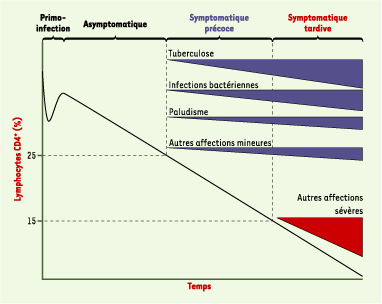
 | Figure 1.
Histoire naturelle de l’infection par le VIH chez l’adulte en Afrique subsaharienne. Autres affections mineures : prurigo, candidose buccale, candidose vaginale, zona, diarrhée inexpliquée, amaigrissement… Autres affections sévères : isosporose, cryptosporidiose, toxoplamose, cryptococcose, mycobactérioses atypiques, sarcome de Kaposi, infections invasives à cytomégalovirus, syndrome cachectique, pneumocystose pulmonaire, candidose œsophagienne… |
Des traitements curatifs et prophylactiques adaptés Parmi les maladies les plus fréquemment en cause dans ce spectre, la tuberculose a d’abord fait l’objet, à juste titre, de la plus forte mobilisation. Son traitement curatif de première intention actuellement recommandé chez les personnes infectées par le VIH en Afrique subsaharienne ne diffère pas de celui des personnes séronégatives [
32]. Les efforts portent maintenant essentiellement sur les moyens d’obtenir une compliance optimale, notamment à travers la directly observed therapy (DOT) [
42]. La chimioprophylaxie primaire antituberculeuse à durée limitée (≤ 12 mois), qui a prouvé son efficacité à court terme sur la réduction de la mortalité et de l’incidence de la tuberculose, est officiellement recommandée depuis huit ans [
43–
45]. La chimioprophylaxie secondaire antituberculeuse, qui est efficace sur la prévention des récidives mais n’a pas prouvé de bénéfice en termes de mortalité, ne fait en revanche pas l’objet d’un consensus [ 32,
46]. La prophylaxie par le triméthoprime-sulfaméthoxazole a prouvé un bénéfice net à être prescrite tôt en Afrique subsaharienne (dès le seuil de 500 CD4+/mm3 ou dès le stade clinique 2 de la classification OMS si les CD4+ ne sont pas mesurables), à la posologie de 160/800 mg par jour. Dans deux essais randomisés réalisés en Côte d’Ivoire, ce bénéfice était d’abord lié à une réduction de la morbidité bactérienne sévère et du paludisme, avant de s’étendre, dans un stade plus tardif, à une efficacité anti-isosporose et anti-toxoplasmose [
40,
47]. Ces particularités de la prophylaxie par le cotrimoxazole pour l’Afrique ont fait l’objet d’un consensus international sous l’égide de l’OMS et de l’Onusida en mai 2000 [
48]. Dans un essai randomisé réalisé en Ouganda, le vaccin antipneumococcique à 23 valences n’a pas prouvé de bénéfice chez des adultes infectés par le VIH, que ce soit en termes de mortalité ou de réduction de la morbidité liée à l’infection par le pneumocoque [
31]. |
L’amélioration des soins prodigués aux personnes infectées en Afrique passe évidemment par une lutte pour l’accès aux traitements antirétroviraux, dont la première étape associe une baisse des prix des médicaments et une subvention par la solidarité internationale. Cette intensification de l’accès aux traitements ne sera pas suffisante si elle n’est pas accompagnée d’un effort de recherche clinique pour améliorer la prise en charge au cours des phases précoce et tardive de la morbidité. Au cours de la phase précoce Cette première phase se situe en amont du seuil de recommandations de mise en route du traitement antirétroviral. Au cours de cette phase, une mobilisation sur la prise en charge de la tuberculose, des maladies bactériennes et du paludisme est porteuse d’une réduction potentielle de la mortalité précoce. Il faut pour cela multiplier les cohortes de personnes infectées par le VIH recrutées tôt, afin de donner aux médecins, dans chaque site, des informations sur l’identification et l’évolution de l’incidence et du profil clinique des maladies rencontrées dans cette phase précoce. Pour certaines d’entre elles (maladies bactériennes et paludisme), cette surveillance est essentielle pour en extraire des algorithmes de traitements présomptifs applicables dans les centres de soins primaires. Il est également nécessaire d’étudier les questions diagnostiques ou thérapeutiques (traitement curatif, prophylaxie primaire et secondaire) spécifiques à chacune de ces maladies ou communes à certaines d’entre elles. Pour la tuberculose, cela nécessite d’innover en matière de diagnostic de certitude (la culture étant inaccessible dans beaucoup de sites), de traitements curatifs plus courts, et de modalités optimales d’application des régimes connus (incluant la DOT). La pratique des chimioprophylaxies primaires et secondaires est actuellement peu répandue, malgré des preuves d’efficacité déjà anciennes, pour trois raisons : un doute sur l’efficacité à long terme d’une prophylaxie primaire à durée limitée (posant la question d’étudier des régimes prolongés), une crainte de sélectionner des germes résistants, mais aussi une difficulté opérationnelle (peu souvent évoquée) à pratiquer cette prophylaxie au quotidien, avec ce que cela implique comme difficulté à gérer les symptômes évocateurs de tuberculose chez des personnes sous chimioprophylaxie [
49]. Pour la prophylaxie par le cotrimoxazole, les recommandations internationales font l’objet d’un débat centré sur deux questions : la prévalence du paludisme et le spectre de sensibilité au cotrimoxazole des bactéries en cause dans la morbidité associée au VIH n’étant pas les mêmes partout, les résultats concluants des essais réalisés en Côte- d’Ivoire sont-ils transposables dans d’autres pays africains [
50] ? Existe-t-il un risque qu’une large utilisation du cotrimoxazole puisse précipiter l’émergence de résistances au cotrimoxazole lui-même, mais aussi à d’autres agents anti-infectieux de première ligne, non seulement chez les personnes prenant du cotrimoxazole, mais aussi dans la population générale [
51,
52] ? Un suivi clinique à long terme des cohortes de personnes recevant cette prophylaxie est donc nécessaire pour continuer à décrire la morbidité sous cotrimoxazole, cette description in vivo étant la seule susceptible de répondre à la question de savoir si le cotrimoxazole continue à avoir un bénéfice sur un site donné, quel que soit le contexte de résistances in vitro [
53]. Une meilleure compréhension des risques de sélection et de diffusion de germes résistants dans la population sous la pression d’une prophylaxie largement appliquée serait également d’autant plus souhaitable que des questions voisines ont déjà contribué à freiner la pratique de la chimioprophylaxie antituberculeuse, et que le même type de débat risque d’émerger dans l’avenir à propos d’autres interventions liées à l’infection par le VIH en Afrique. Après inventaire des mécanismes d’acquisition de résistances des germes en cause et des données épidémiologiques disponibles sur la transmission de ces résistances dans différents contextes, il serait utile de tenter une modélisation de ces risques. Au cours de la phase tardive À ce stade, il y a encore beaucoup à faire pour l’identification du spectre de morbidité, la place de certaines maladies opportunistes restant mal connue dans un grand nombre de sites africains. Cette identification n’est cependant pas porteuse en soi d’espoir de gain en termes de survie si la personne n’a pas accès à un traitement antirétroviral. Cette phase est donc clairement celle où vont se poser les questions qui accompagnent l’organisation de l’accès à des traitements antirétroviraux : quels régimes initiaux, quels critères de mise en route et de surveillance, quels algorithmes de modifications de régimes, quelle place pour des mesures de CD4 et de charge virale à un rythme différent de ceux pratiqués ailleurs, quels problèmes spécifiques peut poser l’observance dans ce contexte… ? On ne dispose actuellement que de rares données concernant la pratique des traitements antirétroviraux en Afrique subsaharienne [
54–
56]. Des cohortes décrivant sur le long terme la morbidité (incluant les effets secondaires), la survie, l’observance et l’évolution des paramètres immunovirologiques (incluant les résistances) chez les personnes sous traitement antirétroviral doivent donc être mises en place ou poursuivies dans le plus grand nombre de sites. Cela pour au moins trois raisons : d’abord, la spécificité de la morbidité liée au VIH en Afrique peut entraîner une fréquence de morbidité sous antirétroviraux différente de ce qui est connu en France, pouvant avoir un retentissement d’autant plus important sur la conduite du traitement que les moyens diagnostiques et le niveau de prise en charge sont différents. Par exemple, l’ampleur du problème des réactivations mycobactériennes pourrait prendre une importance qu’elle n’a pas lorsque le plateau technique permet un diagnostic rapide et bien documenté [
57,
58]. Ensuite, les effets secondaires (types et fréquence) et leur retentissement (qui, à même fréquence, peut être différent du retentissement qu’ils ont en France du fait du niveau de prise en charge) sont susceptibles de conditionner la réussite d’une stratégie thérapeutique [
59]. Enfin, les rares données d’efficacité à court terme actuellement disponibles ont été mises en avant pour illustrer la faisabilité et l’efficacité des traitements antirétroviraux en Afrique subsaharienne, et la nécessité d’élargir l’accès à ces médicaments [54–56]. Sans suivi rigoureux prolongé, il existe un risque que, à l’avenir, des évaluations sommaires des grands programmes nationaux existants concluent à l’inverse à une efficacité médiocre à long terme et donnent l’image de traitements compliqués, difficiles à gérer dans la durée et dans lesquels il vaudrait mieux ne pas investir. |
Même s’il est probablement difficile de rattraper le retard accumulé, rien n’est inéluctable dans la situation catastrophique que vit l’Afrique subsaharienne, qui semble ne jamais finir de s’aggraver. Des interventions efficaces à tous les niveaux (prévention de la transmission du virus, prise en charge des affections précocement liées à l’immunodépression, traitements antirétroviraux) existent. En ce qui concerne le manque d’informations, on sait de quelle façon la recherche devrait étudier les questions sans réponse ou aider à l’émergence de nouvelles questions au fur et à mesure de la mise en œuvre des différentes interventions. Loin d’être démunis d’outils, nous sommes donc avant tout confrontés à un déficit de mobilisation. Ce déficit était parfaitement illustré dès la fin des années 1980 par le retard pris dans la documentation de la spécificité de l’histoire naturelle de la maladie liée au VIH en Afrique. L’avenir dira si la communauté mondiale continue à être en permanence en retard, ou si elle se décide enfin un jour à relever ce défi historique. |
2. Onusida. Survol de l’épidémie dans le monde. Rapport sur l’épidémie mondiale de VIH/sida 2002, chapitre 2 : 21–42. 4. Buvé A, Bishikwabo-Nsarhaza K, Mutangadura G. The spread and effect of HIV-1 infection in sub-Saharan Africa. Lancet 2002; 359 : 2001–17. 5. Zhu T, Korber B, Nahmias A, et al. An African HIV-1 sequence from 1959 and implications for the origin of the epidemic. Nature 1998; 391 : 594–7. 6. Korber B, Muldoon M, Theiler J, et al. Timing the ancestor of the HIV-1 pandemic strains. Science 2000; 288 : 1789–96. 7. Quinn T. Global burden of the HIV pandemic. Lancet 1996; 348 : 99–106. 8. Peeters M, Sharp P. Genetic diversity of HIV-1 : The moving target. AIDS
2000; 14 : 129–40. 9. Buvé A, Caraël M, Hayes R, et al. The multicentre study on factors determining the differential spread of HIV in four African cities : Summary and conclusions. AIDS 2001; 15 : 127–31. 10. Banque mondiale. Rapport sur le développement dans le monde 1993 : investir dans la santé. Paris, 1993, 340 p. 11. Djomand G, Greenberg AE, Sassan-Morokro M, et al. The epidemic of HIV/AIDS in Abidjan, Côte d’Ivoire : A review of data collected by projet RETRO-CI from 1987 to 1993. J Acquir Immune Def Syndr Hum Retrovir 1995; 10 : 358–65. 12. Anglaret X, Gnangbomon J, Coulibaly-Koné S, et al. Clinical and immunological stages of HIV-infected patients attending community clinics, Abidjan, Côte d’Ivoire. Int J
STD AIDS 1998; 9 : 432–3. 13. Grant A, Djomand G, Smets P, et al. Profound immunosuppression across the spectrum of opportunistic disease among hospitalized HIV-infected adults in Abidjan, Côte d’Ivoire. AIDS 1997; 11 : 1357–64. 14. Kamanfu G, Mlika-Cabanne N, Girard P, et al. Pulmonary complications of human immunodeficiency virus infection in Bujumbura, Burundi. Am Rev Respir Dis 1993; 147 : 658–63. 15. Brindle RJ, Nunn PP, Batchelor BI, et al. Infection and morbidity in patients with tuberculosis in Nairobi, Kenya. AIDS 1993; 7 : 1469–74. 16. Clerinx J, Bogaerts J, Taelman H, et al. Chronic diarrhoea among adults in Kigali, Rwanda : association with bacterial enteropathogens, rectocolonic inflammation, and human immunodeficiency virus infection. Clin Infect Dis 1995; 21 : 1282–4. 17. Malin A, Gwanzura L, Klein S, et al.
Pneumocystis carinii pneumonia in Zimbabwe. Lancet 1995; 346 : 1258–61. 18. Daley C, Mugusi F, Chen L, et al. Pulmonary complications of HIV infection in Dar es Salaam, Tanzania. Role of bronchoscopy and bronchoalveolar lavage. Am J Respir
Crit Care Med 1996; 154 : 105–10. 19. Jones N, Huebner R, Khoosal M, et al. The impact of HIV on Streptococcus pneumoniae bacteraemia in a South African population. AIDS 1998; 12 : 2177–84. 20. Archibald L, McDonald L, Nwanyanwu O, et al. A hospital-based prevalence survey of bloodstream infections in febrile patients in Malawi : implications for diagnosis and therapy. J Infect Dis 2000; 181 : 1414–20. 21. Batungwanayo J, Taelman H, Allen S, et al. Pleural effusion, tuberculosis and HIV-1 infection in Kigali, Rwanda. AIDS 1993; 7 : 73–9. 22. Batungwanayo J, Taelman H, Lucas S, et al. Pulmonary disease associated with the human immunodeficiency virus in Kigali, Rwanda : a fibre optic bronchoscopic study of 111 cases of undetermined etiology. Am J Respir Crit Care Med 1994; 6 : 1591–6. 23. Gilks C, Brindle R, Otieno L, et al. Life-threatening bacteraemia in HIV-1 seropositive adults admitted to hospital in Nairobi, Kenya. Lancet 1990; 346 : 545–9. 24. Scott J, Hall A, Muyodi C, et al. Aetiology, outcome, and risk factors for mortality among adults with acute pneumonia in Kenya. Lancet 2000; 355 : 1225–30. 25. Vugia DJ, Kiehlbauch JA, Yeboue K, et al. Pathogens and predictors of fatal septicemia associated with the human immunodeficiency virus infection in Ivory Coast, West Africa. J Infect Dis 1993; 168 : 564–70. 26. Mwachari C, Batchelor B, Paul J, et al. Chronic diarrhoea among HIV-infected adult patients in Nairobi, Kenya. J Infect 1998; 37 : 48–53. 27. Germani Y, Minssart P, Vohito M, et al. Etiologies of acute, persistent, and dysenteric diarrheas in adults in Bangui, Central African republic, in relation to human immunodeficiency virus serostatus. Am J Trop Med Hyg 1998; 59 : 1008–14. 28. Lucas SB, Hounnou A, Peacock C, et al. The mortality and pathology of HIV infection in a West African city. AIDS 1993; 7 : 1569–79. 29. Leroy V, Msellati P, Lepage P, et al. Natural history of HIV-1 infection in African women : a prospective cohort study in Kigali, Rwanda, 1988-1993. J Acquir Immune Def Syndr 1995; 9 : 415–21. 30. Gilks C, Ojoo S, Brindle R, et al. Invasive pneumococcal disease in a cohort of predominantly HIV-1 infected female sex-workers in Nairobi, Kenya. Lancet 1996; 347 : 718–23. 31. French N, Nakiyingi J, Carpenter L, et al. 23-valent pneumococcal polysaccharide vaccine in HIV-1-infected Ugandan adults : double-blind, randomised and placebo controlled trial. Lancet 2000; 355 : 2106–11. 32. Perriëns JH, St Louis ME, Mukadi YB, et al. Pulmonary tuberculosis in HIV-infected patients in Zaïre. A controlled trial of treatment for either 6 or 12 months. N Engl J Med 1995; 332 : 779–84. 33. Allen S, Batungwanayo J, Kerlikowske K, et al. Two-year incidence of tuberculosis in cohorts of HIV-infected and uninfected urban Rwandan women. Am J Med 1992; 146 : 1439–44. 34. Ackah AN, Coulibaly D, Digbeu H, et al. Response to treatment, mortality, and CD4 lymphocytes counts in HIV-infected persons with tuberculosis in Abidjan, Côte d’Ivoire. Lancet 1995; 345 : 607–10. 35. Morgan D, Maude G, Malambra S, et al. HIV-1 disease progression and AIDS-defining disorders in rural Uganda. Lancet 1997; 350 : 245–50. 36. Sewankambo N, Gray R, Ahmad S, et al. Mortality associated with HIV infection in rural Rakai District, Uganda. AIDS 2000; 14 : 2391–400. 37. French N, Mujugira A, Nakiyingi J, et al. Immunologic and clinical stages in HIV-1-infected Ugandan adults are comparable and provide no evidence of rapid progression but poor survival with advanced disease. J Acquir Immune Def Syndr 1999; 22 : 509–16. 38. Malamba S, Morgan D, Clayton T, et al. The prognostic value of the World health organisation staging system for HIV infection and disease in rural Uganda. AIDS 1999; 13 : 2555–62. 39. Whitworth J, Morgan D, Quigley M, et al. Effect of HIV-1 and increasing immunosppression on malaria parasitemia and clinical episodes in adults in rural Uganda. Lancet 2000; 356 : 1051–6. 40. Anglaret X, Chene G, Attia A, et al. Early chemoprophylaxis with trimetoprim-sulphamethoxazole for HIV-1 infected adults in Abidjan, Côte d’Ivoire : a randomised trial. Lancet 1999; 353 : 1462–8. 41. Anglaret X, Messou E, Ouassa T, et al. Pattern of bacterial diseases in a cohort of HIV-1 infected adults receiving cotrimoxazole prophylaxis, Abidjan, Côte d’Ivoire. AIDS 2003; 17 : 575–84. 42. De Cock K, Chaisson R. Will DOTS do it ? A reappraisal of tuberculosis control in countries with high rates of HIV infection. Int J Tuberc Lung
Dis 1999; 3 : 457–65. 43. Whalen C, Jonhson J, Okwera A, et al. A trial of three regimens to prevent tuberculosis in Ugandan adults infected with the human immunodeficiency virus. N Engl J Med 1997; 337 : 801–8. 44. Unaids/WHO. Preventive therapy against tuberculosis in people living with HIV. Wkly Epidemiol Rec 1999; 74 : 385–400. 45. Quigley M, Mwinga A, Hosp M, et al. Long-term effect of preventive therapy for tuberculosis in a cohort of HIV-infected Zambian adults. AIDS 2001; 15 : 215–22. 46. Fitzgerald D, Desvarieux M, Severe P, et al. Effect of post-treatment isoniazid on prevention of recurrent tuberculosis in HIV-1-infected individuals : a randomised trial. Lancet 2000; 356 : 1470–4. 47. Wiktor S, Sassan-Morokro M, Grant A, et al. Efficacy of trimethoprim-sulphamethoxazole prophylaxis to decrease morbidity and mortality in HIV-1-infected patients with tuberculosis in Abidjan, Côte d’Ivoire : a randomised controlled trial. Lancet 1999; 353 : 1469–75. 49. Anglaret X, Dabis F, Batungwanayo J, et al. Chimioprophylaxie primaire de la tuberculose chez les séropositifs dans les pays non industrialisés. Santé 1997; 7 : 89–94. 50. Boeree M, Harries A, Zijlstra E, et al. Co-trimoxazole in HIV-1 infection. Lancet 1999; 354 : 334. 51. Iyer J, Milhous W, Cortese J, et al.
Plasmodium falciparum cross-resistance between trimethoprim and pyrimethamine. Lancet 2001; 358 : 1066–7. 52. Martin J, Rose D, Hadley W, et al. Emergence of trimethoprim-sulfamethoxazole resistance in the AIDS era. J Infect Dis 1999; 180 : 1809–18. 53. Anglaret X. Cotrimoxazole prophylaxis in sub-Saharan Africa. Lancet 2001; 358 : 1027–8. 54. Weidle P, Malamba S, Mwebaze R, et al. Assessment of a pilot antiretroviral drug therapy programme in Uganda : patients’ response, survival, and drug resistance. Lancet 2002; 360 : 34–40. 55. Laurent C, Diakhate N, Gueye N, et al. The Senegalese government’s highly active antiretroviral therapy initiative : an 18-month follow-up study. AIDS 2002; 16 : 1363–70. 56. Seyler C, Anglaret X, Dakoury-Dogbo N, et al. Medium-term survival, morbidity, and immuno-virological evolution in HIV-infected adults receiving antiretroviral therapy, Abidjan, Côte d’Ivoire. Antivir Ther 2003; 8 : 385–93. 57. Race E, Adelson-Mitty J, Kriegel G, et al. Focal mycobacterial lymphadenitis following initiation of protease-inhibitor therapy in patients with advanced HIV-1 disease. Lancet 1998; 351 : 252–5. 58. French M, Lenzo N, John M, et al. Immune restoration disease after the treatment of immunodeficient HIV-infected patients with highly active antiretroviral therapy. HIV Med 2000; 1 : 107–15. 59. Heath K, Singer J, O’Shaughnessy M, et al. Intentional nonadherence due to adverse symptoms associated with antiretroviral therapy. J Acquir Immune Def Syndr 2002; 31 : 211–7. |