| |
| Med Sci (Paris). 2004 April; 20(4): 453–457. Published online 2004 April 15. doi: 10.1051/medsci/2004204453.Carcinomes nasopharyngés associés au virus d’Epstein-Barr De l’épidémiologie à la thérapeutique et au dépistage Pierre Busson,1 Tadamassa Ooka,2 and Marilys Corbex3 1CNRS UMR 8126, Institut Gustave-Roussy, 39, rue Camille Desmoulins, 94805 Villejuif Cedex, France 2CNRS UMR 5537, Faculté de médecine Laennec, rue Guillaume Paradin, 69372 Lyon Cedex, France 3Unité d’épidémiologie génétique, Centre international de recherche sur le cancer, 150, cours Albert Thomas, 69372 Lyon Cedex 08, France |
Les carcinomes nasopharyngés (NPC) représentent une entité très particulière parmi les tumeurs malignes d’origine épithéliale. Leur répartition géographique est tout à fait inégale et surprenante : ils sont rares dans la plupart des pays du monde, mais fréquents dans certaines régions du globe comme l’Extrême-Orient ou l’Afrique du Nord. Ils sont associés de façon constante au virus d’Esptein-Barr (EBV), quelle que soit l’origine géographique des patients. Enfin, du point de vue histologique, ils se caractérisent par la présence d’un infiltrat lymphocytaire très abondant. La recherche biologique et thérapeutique sur les NPC souffre de l’éloignement géographique entre les zones d’endémie et les institutions de recherche les mieux équipées. D’où l’importance d’un atelier Nord-Sud sur cette thématique. |
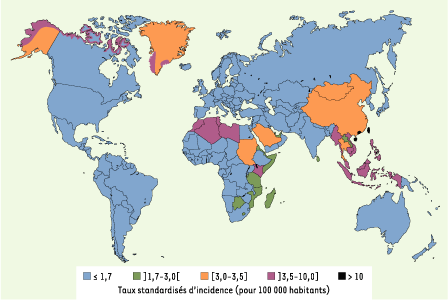
Une répartition géographique étonnante, reflétant une étiologie complexe Les NPC sont rares dans la plupart des pays du monde, et notamment en Europe (incidence annuelle inférieure à 1/100 000). Les foyers de haute incidence se situent en Extrême-Orient, principalement en Chine du sud (incidence annuelle de 25/100 000 à Canton). Il existe également des zones d’incidence intermédiaire dont l’extension a longtemps été sous-estimée : Afrique du Nord, Indonésie, Vietnam, Kenya, Groenland (incidence annuelle de 3 à 8/100 000) [
1] (Figure 1). La distribution tout à fait surprenante des NPC pourrait s’expliquer par les effets conjugués, variables suivant les populations concernées, de facteurs de prédisposition génétique et de facteurs de risque environnementaux, ainsi que par la diffusion de souches d’EBV plus agressives dans certaines populations.
 | Figure 1.
Distribution géographique des carcinomes nasopharyngés chez les individus de sexe masculin. Document établi par l’unité d’épidémiologie génétique du Centre international de recherche sur le cancer (CIRC, Lyon) d’après GLOBOCAN 2000 [
26] ; pour les données sur le Groenland, communication personnelle de J. Friborg. |
Jusqu’à ce jour, les facteurs de risque environnementaux ont été principalement étudiés en Extrême-Orient. Ces études ont fait ressortir un risque majeur lié à la consommation de poisson conservé par salaison suivant un procédé spécifiquement cantonnais [1]. En Afrique du Nord, d’autres facteurs alimentaires sont incriminés, notamment certains condiments et certaines graisses animales (graisse de mouton, beurre rance) [
2,
3]. La ventilation insuffisante des locaux d’habitation semble également être un facteur de risque important (communications de M. Corbex, Lyon, France, M. Hamdi-Cherif, Sétif, Algérie, et S. Ammor, Marrakech, Maroc). La part des facteurs héréditaires reste difficile à évaluer. La diminution constante de l’incidence des NPC constatée à Hong Kong depuis 1973 suggère que les gènes de susceptibilité au NPC ont une faible pénétrance et agissent surtout comme modulateurs de la réponse à des agressions environnementales [1]. Il existe en Chine du sud des cas d’agrégations familiales fortes (plus de trois cas par famille, exposé de W.H. Jia, Canton, Chine). Ces cas sont rares, mais leur étude est susceptible d’apporter un éclairage décisif sur les mécanismes de prédisposition génétique. Les études de liaison réalisées sur deux séries de familles ont fait apparaître deux locus de prédisposition distincts : l’un au niveau du chromosome 4p, l’autre au niveau du 5p13 (communications de H. Li Fu, Stockholm, Suède, et de Y. Xin Zeng, Canton, Chine ; voir aussi [
4]). D’autres travaux concernent l’influence du polymorphisme des systèmes HLA de classes I et II, pour lesquels les allèles à risque sont assez différents en Extrême-Orient (A2, B46, DRβ03) et en Afrique du Nord (B13, DRβ03) ([
5,
6] et communication de H. Makni, Sfax, Tunisie). Ces différences pourraient s’éclairer à la lumière des connaissances nouvelles relatives au polymorphisme de l’EBV. On peut supposer que, pour une région géographique donnée, les possibilités d’échappement immunitaire sont conditionnées à la fois par l’éventail des souches virales les plus fréquentes et par celui des allèles HLA les plus représentés. L’EBV est un virus ubiquitaire dans l’espèce humaine (plus de 95 % des sujets adultes sont porteurs sains séropositifs, quelle que soit la population concernée). Les porteurs sains d’EBV sont généralement infectés par plusieurs souches virales qui circulent dans les compartiments sanguins et oropharyngés [
7]. Chez les malades souffrant d’un NPC, la diversité des souches est plus réduite dans le tissu tumoral que dans la salive ou le sang circulant ; dans la plupart des cas, une seule souche est présente dans la tumeur (communications de H. Karray, Sfax, et de J. Nicholls, Hong Kong) [
8]. Fait remarquable, on a pu observer à plusieurs reprises dans des isolats tumoraux la présence de polymorphismes additionnels, « sporadiques », responsables d’une modification de la séquence des épitopes cibles des lymphocytes T cytotoxiques anti-EBV restreints au HLA (communications de N. Raab-Traub, Chapel Hill, États-Unis, et de Y.X. Zeng, Canton) [
9]. L’avenir dira si certaines souches sont plus aptes que d’autres à produire de tels variants, et si les variants « sélectionnés » dans les cellules tumorales diffèrent également quant à leurs effets sur les mécanismes de signalisation cellulaire. |
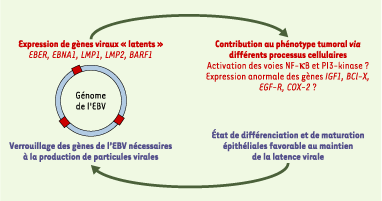
Contributions du virus d’Epstein-Barr et des altérations génétiques cellulaires à l’oncogenèse Dans les cellules malignes de carcinome nasopharyngé, aucune particule virale n’est détectable. C’est la présence d’ADN viral dans le noyau de toutes les cellules malignes qui a constitué le premier indicateur de la contribution du virus au processus tumoral. Les interactions virus/cellules sont réciproques (Figure 2). Un petit nombre de gènes viraux, de l’ordre de 5 à 10, codent pour des protéines participant probablement à l’entretien du phénotype malin. D’un autre côté, un ensemble de facteurs cellulaires « verrouillent » le reste des gènes viraux contribuant normalement à la synthèse des particules virales ; ces gènes, au nombre d’une centaine, sont appelés gènes du cycle viral « productif ».
 | Figure 2.
Représentation schématique des interactions virus/cellule dans les cellules épithéliales malignes de carcinome nasopharyngé (NPC). Le génome circularisé de l’EBV contenu dans les cellules malignes de NPC est représenté à gauche par un cercle. Les parties bleues du cercle symbolisent les gènes viraux dont l’activité est nécessaire à la production de particules virales. Ces gènes sont inactifs dans la grande majorité des cellules de NPC. Les portions rouges du cercle symbolisent les gènes viraux actifs même en l’absence de production de particules virales (gènes « latents »). Les produits de ces gènes sont de petits ARN non traduits (les EBER, Epstein-Barr encoded RNA) et des protéines telles que EBNA1 ( Epstein-Barr nuclear antigen 1), LMP ( latent membrane protein) 1 et 2, BARF1 (BamHI A open reading frame 1). Un certain nombre d’arguments expérimentaux suggèrent que les produits des gènes « latents » contribuent à l’entretien du phénotype malin. Par exemple, la LMP1 activerait des complexes NF-kB p50/p50 et stimulerait l’expression de l’EGF-R ( epidermal growth factor receptor) et de la COX2 (cyclooxygénase 2) [
10,
11]. |
Les gènes viraux les plus abondamment transcrits dans les NPC codent pour de petits ARN non messagers, appelés EBER 1 et 2 (Epstein-Barr encoded RNA), inclus dans des particules ribonucléoprotéiques. Ils peuvent se lier à la PKR (protéine kinase dépendante des ARN), inhiber sa phosphorylation et bloquer ainsi la réponse cellulaire aux interférons [
12]. Ils peuvent en outre activer la transcription du gène codant pour l’IGF- 1 (insulin-like growth factor- 1) par un mécanisme qui doit encore être élucidé (communication de K. Takada, Sapporo, Japon). Deux protéines virales décrites initialement dans les lymphocytes B transformés in vitro par l’EBV sont également détectées dans les NPC : EBNA1 (Epstein-Barr nuclear antigen 1), exprimée dans 100 % des NPC, et LMP1 (latent membrane protein 1), exprimée dans 50 % des cas. On sait depuis peu qu’EBNA1 peut transactiver l’expression du gène antiapoptotique Bcl-X [
13], lui-même surexprimé de façon constante dans les cellules de NPC (communication de A. Khabir, Sfax ; voir aussi [
14]). D’autres gènes viraux (BARF0, BARF1 et LMP2) sont transcrits dans les cellules de NPC mais, en dépit de l’abondance de leurs messagers, les protéines correspondantes sont difficiles à détecter. Au cours de cet atelier, L. Young (Birmingham, Grande-Bretagne) a créé la surprise en présentant pour la première fois des images de détection de LMP2 dans des coupes histologiques de NPC. Pour mémoire, dans certaines lignées épithéliales in vitro, la protéine LMP2 présente une activité transformante assurée notamment par l’activation de la voie PI3-kinase/Akt (communication de N. Raab-Traub, Chapel Hill). Par ailleurs, la détection de la protéine BARF1 dans les cellules de NPC a été rapportée en 2000 par le groupe de T. Ooka [
15] et confirmée au cours de l’atelier par K. Takada (Sapporo). Abondamment sécrétée, elle est faiblement retenue à l’intérieur des cellules, ce qui d’ailleurs ne facilite certainement pas sa détection. Sous sa forme sécrétée, la protéine BARF1 a les propriétés d’un facteur de croissance (communication de T. Ooka, Lyon, France). Au total, il paraît de plus en plus probable que le virus d’Epstein-Barr joue un rôle dans l’oncogenèse des NPC. Cependant, il n’est qu’un cofacteur parmi d’autres. La transformation maligne des cellules épithéliales nasopharyngées requiert des altérations génétiques cellulaires dont l’effet s’ajoute à celui de l’infection latente par l’EBV. Pour l’instant, il n’y a qu’un seul gène suppresseur de tumeur dont l’implication soit démontrée de façon claire : il s’agit du gène, localisé en 9p 21, codant pour la protéine p16/Ink 4, absente dans 60 % des cellules malignes de NPC [
16]. Les autres altérations les plus fréquentes sont des pertes en 3p13-3p26 et des gains en 12p12 (communication de Zhongxi Huang, Canton et de S. Rodriguez, Villejuif). |
En quête de nouvelles méthodes pour le dépistage Les NPC se développent dans une cavité anatomique peu accessible à l’examen clinique. L’extension tumorale à distance, ou dans les structures anatomiques voisines (notamment la base du crâne), aggrave considérablement le pronostic. C’est dire l’importance des approches biologiques pour la mise en place de tests de dépistage fiables, et si possible peu onéreux. La plupart des approches proposées ont pour objectif de mettre en évidence des changements dans la relation virus-hôte qui précéderaient ou accompagneraient le développement de la tumeur. La détection des immunoglobulines A anti-EBV a rendu de grands services en Chine du sud, là où elle a été appliquée à grande échelle. Mais comme l’a rappelé son meilleur avocat, G. de Thé, sa spécificité n’est pas excellente (en Chine du sud, 2,5 % des individus de la population générale sont IgA positifs, mais moins de 3 % d’entre eux développent un NPC) [
17]. Beaucoup d’efforts visent à perfectionner les analyses sérologiques et à identifier les combinaisons de marqueurs susceptibles de présenter la meilleure valeur prédictive (communications de M. Kyatthi, Casablanca, Maroc, H. Karray, Sfax, H. Melouli, Alger) [
18]. La détection de l’ADN viral dans le sang périphérique est envisagée par certains auteurs [
19]. D’après J. Middeldorp (Amsterdam, Pays-Bas), sa détection dans les frottis nasopharyngés serait un procédé plus sensible et spécifique. Il semble en effet qu’en l’absence de NPC, la production ou la libération d’ADN de l’EBV dans la cavité nasopharyngée soit très limitée. |
Autres affections malignes épithéliales potentiellement associées au virus d’Epstein-Barr Semaine après semaine, paraissent des observations suggérant une implication du virus d’Esptein-Barr dans un large éventail de tumeurs malignes humaines d’origine épithéliale (voir par exemple [
20,
21]). L’association à l’EBV est indiscutable pour environ 10 % des cas de carcinomes gastriques (communication de J. Middeldorp, Amsterdam ; voir aussi [
22]). Qu’en est-il pour les autres tumeurs épithéliales ? S’agissant des carcinomes mammaires, un consensus se dégage sur le fait que le génome de l’EBV, s’il est présent, n’est contenu que dans un petit nombre de cellules. S’agit-il de cellules épithéliales malignes, ou seulement de lymphocytes infiltrants ? Des expériences combinant microdissection et PCR plaident en faveur de la première hypothèse (communication d’I. Joab, Paris, France). Le même groupe montre qu’en infectant artificiellement in vitro des cellules épithéliales mammaires par l’EBV, on induit l’expression des gènes Cox- 2 (cyclooxygénase- 2) et MDR1 (multidrug resistance gene), qui peuvent être liés à la progression tumorale et à la résistance à la chimiothérapie ; ces résultats suggèrent que l’infection de certaines cellules malignes par l’EBV in situ pourrait favoriser l’émergence de sous-clones plus agressifs. On peut noter qu’une hypothèse similaire vient d’être proposée concernant les carcinomes thyroïdiens [21]. Il semble ainsi clair que les modalités d’association EBV-carcinomes mammaires ne sont pas les mêmes que dans les NPC. Un nouvel éclairage important sur ce thème vient d’ailleurs d’être apporté par le groupe de D. Hayward ; leur étude suggère que l’infection par l’EBV des cellules de carcinome mammaire se fait préférentiellement sur le mode lytique/productif, avec une forte charge virale dans un très petit nombre de cellules malignes [
23]. Cependant, malgré ces disparités, il est probable qu’une meilleure connaissance des interactions virus-cellules dans les NPC devrait permettre de guider les recherches sur le rôle de l’EBV dans d’autres tumeurs épithéliales. |
Nouvelles approches thérapeutiques Les NPC sont en moyenne plus radiosensibles et chimiosensibles que les autres carcinomes des voies aérodigestives supérieures, au moins à la phase initiale du traitement. Cependant, les rechutes métastatiques et les récidives locales sont encore trop fréquentes. La radiothérapie reste l’arme principale pour le traitement de la tumeur primitive ; l’espoir d’être plus efficace sur la tumeur tout en épargnant les tissus sains environnants repose sur le développement de nouveaux procédés balistiques, notamment celui de la radiothérapie conformationnelle avec modulation d’intensité (IMRT) (communications de R.J. Bensadoun, Nice, France et de J. Payne et J. Waldron, Toronto, Canada). La plupart des travaux sur les thérapeutiques biologiques ciblées cherchent à tirer parti de la présence du génome viral dans les cellules malignes. Pour le groupe de S. Kenney (Chapel Hill), il s’agit de provoquer une rupture de la latence virale dans les cellules malignes de NPC afin d’induire la synthèse d’enzymes virales capables de métaboliser des prodrogues. Dans certaines lignées tumorales de NPC, des médicaments comme le 5-fluoro-uracile (5-FU) ou le cisplatine, couramment utilisés en chimiothérapie, ont pour effet accessoire de provoquer une rupture de la latence virale qui s’accompagne de l’expression d’enzymes de l’EBV à activité kinase (thymidine kinase et produit du gène BGLF4) capables de métaboliser le ganciclovir ; cet effet est dépendant, entre autres, d’une activation de la MAP-kinase p38. Comme on pouvait l’espérer, l’adjonction de ganciclovir potentialise l’effet cytotoxique du 5-FU dans ces lignées [
24]. La possibilité de transposer cette approche en clinique dépendra de la facilité avec laquelle on pourra obtenir chez les malades une rupture de la latence virale dans les tumeurs, ce qui reste à explorer. Le groupe de F.F. Liu (Toronto) élabore quant à lui une approche de thérapie génique fondée sur l’utilisation d’adénovirus recombinants avec expression ou réplication conditionnelle [
25]. Ces adénovirus ont été redessinés de façon à se répliquer exclusivement dans les cellules exprimant la protéine EBNA1. En outre, ces vecteurs sont « armés » de gènes codant pour des protéines proapoptotiques telles que le ligand de Fas ou la protéine Bim. L’injection intratumorale de ces vecteurs dans des NPC xénogreffés, en combinaison avec une irradiation externe de ces derniers, permet d’obtenir une régression macroscopiquement complète, même si elle est seulement provisoire, de ces tumeurs. Par ailleurs, la diffusion systémique de ces adénovirus réplicatifs, notamment dans le foie, reste heureusement très limitée. Enfin, l’immunothérapie n’a pas dit son dernier mot, comme le montrent les résultats encourageants d’un essai de phase I fondé sur l’utilisation de cellules dendritiques autologues chargées avec des peptides représentatifs de la LMP2 (communication de C.L. Lin, Taïwan). |
Au terme de cet atelier, les carcinomes nasopharyngés semblent plus que jamais constituer une thématique majeure en biologie des tumeurs, thématique de caractère multidisciplinaire et fédérateur. L’effectif des populations à risque dans le monde est considérable. Les perspectives d’approches thérapeutiques nouvelles sont prometteuses. Enfin, les recherches épidémiologiques, biologiques et thérapeutiques sur les NPC devraient permettre d’élucider des mécanismes pathologiques probablement applicables à d’autres affections malignes humaines. |
L’atelier Nord-Sud sur les carcinomes nasopharyngés s’est tenu avec le soutien des organismes suivants : Centre international de recherche sur le cancer (Lyon), Institut Gustave Roussy (Villejuif), Fondation de France, CNRS, Inserm, Institut français de coopération (Tunis), Fondation Mérieux, DGRST tunisienne, Faculté de médecine et Hôpital universitaire de Sfax (Tunisie), programme Asialink de la Communauté européenne, Société française du cancer, Année de l’Algérie en France, ainsi que plusieurs compagnies pharmaceutiques ou biotechnologiques (Schering-Plough, Merck-Lipha, Aventis-Intercontinental, Ipsen, VWR, Argene).
|
Footnotes |
1. Yu MC, Yuan JM. Epidemiology of nasopharyngeal carcinoma. Semin Cancer Biol 2002; 12 : 421–9. 2. Jeannel D, Hubert A, de Vathaire F, et al. Diet, living conditions and nasopharyngeal carcinoma in Tunisia - a case-control study. Int J Cancer 1990; 46 : 421–5. 3. Laouamri S, Hamdi-Cherif M, Sekfali N, et al. Facteurs de risque alimentaires du carcinome du nasopharynx dans la région de Sétif (Algérie). Rev Epidemiol Sante Publique 2001; 49 : 145–56. 4. Feng BJ, Huang W, Shugart YY, et al. Genome-wide scan for familial nasopharyngeal carcinoma reveals evidence of linkage to chromosome 4. Nat Genet 2002; 31 : 395–9. 5. Mokni-Baizig N, Ayed K, Ayed FB, et al. Association between HLA-A/-B antigens and -DRB1 alleles and nasopharyngeal carcinoma in Tunisia. Oncology 2001; 61 : 55–8. 6. Dardari R, Khyatti M, Jouhadi H, et al. Study of human leukocyte antigen class I phenotypes in Moroccan patients with nasopharyngeal carcinoma. Int J Cancer 2001; 92 : 294–7. 7. Sitki-Green D, Covington M, Raab-Traub N. Compartmentalization and transmission of multiple Epstein-Barr virus strains in asymptomatic carriers. J Virol 2003; 77 : 1840–7. 8. Nicholls J, Hahn P, Kremmer E, et al. Detection of wild type and deleted latent membrane protein 1 (LMP1) of Epstein-Barr virus in clinical biopsy material. J Virol Methods 2004; 116 : 79–88. 9. Edwards RH, Sitki-Green D, Moore DT, Raab-Traub N. Potential selection of LMP1 variants in nasopharyngeal carcinoma. J Virol 2004; 78 : 868–81. 10. Thornburg NJ, Pathmanathan R, Raab-Traub N. Activation of nuclear factor-kappaB p50 homodimer/Bcl-3 complexes in nasopharyngeal carcinoma. Cancer Res 2003; 63 : 8293–301. 11. Murono S, Inoue H, Tanabe T, et al. Induction of cyclooxygenase-2 by Epstein-Barr virus latent membrane protein 1 is involved in vascular endothelial growth factor production in nasopharyngeal carcinoma cells. Proc Natl Acad Sci USA 2001; 98 : 6905–10. 12. Nanbo A, Inoue K, Adachi-Takasawa K, Takada K. Epstein-Barr virus RNA confers resistance to interferon-alpha-induced apoptosis in Burkitt’s lymphoma. EMBO J 2002; 21 : 954–65. 13. Tsimbouri P, Drotar ME, Coy JL, Wilson JB. Bcl-xL and RAG genes are induced and the response to IL-2 enhanced in EmuEBNA-1 transgenic mouse lymphocytes. Oncogene 2002; 21 : 5182–7. 14. Khabir A, Ghorbel A, Daoud J, et al. Similar BCL-X but different BCL-2 levels in the two age groups of North African nasopharyngeal carcinomas. Cancer Detect Prev 2003; 27 : 250–5. 15. Decaussin G, Sbih-Lammali F, de Turenne-Tessier M, et al. Expression of BARF1 gene encoded by Epstein-Barr virus in nasopharyngeal carcinoma biopsies. Cancer Res 2000; 60 : 5584–8. 16. Gulley ML, Nicholls JM, Schneider BG, et al. Nasopharyngeal carcinomas frequently lack the p16/MTS1 tumor suppressor protein but consistently express the retinoblastoma gene product. Am J Pathol 1998; 152 : 865–9. 17. Ablashi D, Bornkamm GW, Boshoff C, et al. Proceedings of the IARC Working Group on the evaluation of carcinogenic risks to humans. Epstein-Barr virus and Kaposi’s sarcoma herpesvirus/human herpesvirus 8. Lyon, France, 17-24 June 1997. IARC Monogr Eval Carcinog Risks Hum 1997; 70 : 1–492. 18. Dardari R, Hinderer W, Lang D, et al. Antibody responses to recombinant Epstein-Barr virus antigens in nasopharyngeal carcinoma patients : complementary test of ZEBRA protein and early antigens p54 and p138. J Clin Microbiol 2001, 39 : 3164–70. 19. Chan KCA, Lo YMD. Circulating EBV DNA as a tumor marker for nasopharyngeal carcinoma. Semin Cancer Biol 2002; 12 : 489–96. 20. Liu HX, Ding YQ, Li X, Yao KT. Investigation of Epstein-Barr virus in Chinese colorectal tumors. World J Gastroenterol 2003; 9 : 2464–8. 21. Shimakage M, Kawahara K, Sasagawa T, et al. Expression of Epstein-Barr virus in thyroid carcinoma correlates with tumor progression. Hum Pathol 2003; 34 : 1170–7. 22. Zur Hausen A, Brink AA, Craanen ME, et al. Unique transcription pattern of Epstein-Barr virus (EBV) in EBV-carrying gastric adenocarcinomas : expression of the transforming BARF1 gene. Cancer Res 2000; 60 : 2745–8. 23. Huang J, Chen H, Hutt-Fletcher L, et al. Lytic viral replication as a contributor to the detection of Epstein-Barr virus in breast cancer. J Virol 2003; 77 : 13267–74. 24. Feng WH, Israel B, Raab-Traub N, et al. Chemotherapy induces lytic EBV replication and confers ganciclovir susceptibility to EBV-positive epithelial cell tumors. Cancer Res 2002; 62 : 1920–6. 25. Li JH, Shi W, Chia M, et al. Efficacy of targeted FasL in nasopharyngeal carcinoma. Mol Ther 2003; 8 : 964–73. 26. Ferlay J, Bray F, Pisani P, Parkin DM. IARC cancerBase n° 5. Lyon : IARC Press, 2001. |