| |
| Med Sci (Paris). 2004 March; 20(3): 274–277. Published online 2004 March 15. doi: 10.1051/medsci/2004203274.L’opsine en liberté, une des causes de l’amaurose congénitale de Leber Simone Gilgenkrantz* 9, rue basse, 54330 Clerey-sur-Brenon, France MeSH keywords: Protéines de transport, Protéines de l'oeil, Humains, Mutation, Atrophie optique héréditaire de Leber, Cellules photoréceptrices, Épithélium pigmentaire de l'oeil, Protéines, Opsines des bâtonnets, Cis-trans-isomerases |
Décrite en 1869 par Theodor Leber, l’amaurose congénitale (LCA) est une entité clinique caractérisée par un déficit visuel, diagnostiqué à la naissance ou dans les premiers mois de la vie, et transmis, dans la quasi-totalité des cas, de façon récessive autosomique. Elle représente au moins 5 % des dystrophies rétiniennes et constitue l’une des principales causes de cécité chez l’enfant [
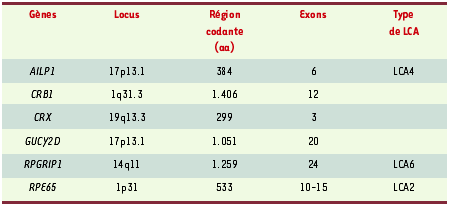
1]. L’extinction de l’électrorétinogramme atteste de l’atteinte des deux types de récepteurs : cônes et bâtonnets. Elle peut accompagner des désordres systémiques (syndromes de Joubert, de Lhermitte-Duclos, de Refsum, et de Zellweger, entre autres). Dans sa forme non syndromique, la LCA regroupe un ensemble de dystrophies rétiniennes dont l’origine génétique est très hétérogène et dont la classification est encore incomplète. Des locus - 14q24 pour LCA3 et 6q11-q16 pour LCA5 - ont été trouvés mais pas les gènes correspondants. Des mutations attestent l’implication de six gènes (Tableau I), mais elles ne sont impliquées que dans 50 % des LCA observées en clinique [
2].  | Tableau I. Localisation et nombre d’exons des gènes impliqués dans les LCA, avec classification de quelques types. aa : acides aminés. |
|
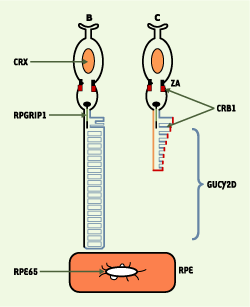
Gènes et produits de gènes impliqués dans la LCA Les six gènes impliqués dans les LCA - qui interviennent aussi dans d’autres dystrophies rétiniennes, à l’exception de RPGRPI1 - sont exprimés exclusivement ou principalement dans les photorécepteurs ou l’épithélium pigmentaire de la rétine (RPE). La localisation sub-cellulaire des protéines codées par ces gènes est un préalable pour comprendre leur rôle dans la différenciation et le fonctionnement des photorécepteurs et/ou dans la cascade des mécanismes de phototransduction (Figure 1). 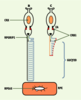 | Figure 1.Schéma des photoneurones aves les localisations subcellulaires des protéines codées par les gènes LCA (couleurs correspondant aux localisations) (B : bâtonnets, et C : cônes). CRX (orange) : facteur de transcription à localisation nucléaire. CRB1 (rouge) : situé dans la zonula adherens (ZA) des segments internes des cônes et des bâtonnets et dans la membrane plasmique du segment externe des cônes. GUCY2D (bleu) : plus abondant dans la région marginale du segment externe des cônes. RPGRIP1 (vert) : segment externe des bâtonnets. RPE65 (noir) : membranes microsomales dérivées du réticulum endoplasmique du RPE (d’après [ 2]). |
On savait qu’il existait, pour cette forme de LCA, un modèle canin spontané chez des Briards atteints de cécité nocturne, tous porteurs de la même délétion de 4pb dans le gène RPE65, ce qui suggère un effet fondateur [
6]. Il existe aussi un modèle murin transgénique, avec invalidation du gène Rpe65 et dégénérescence rétinienne progressive. C’est à partir de ces souris Rpe65−/− que des chercheurs ont découvert et analysé le trouble fonctionnel entraînant la dégénérescence des photoneurones. Auparavant, il est utile de rappeler les grandes lignes de la transduction du signal lumineux. |
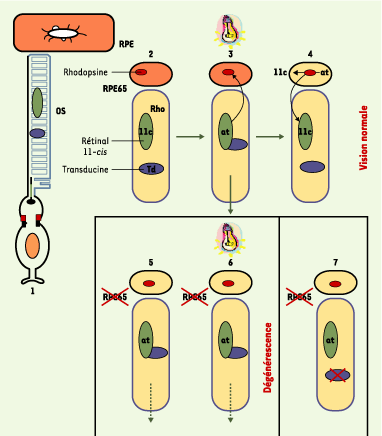
Phototransduction avec et sans RPE65 À l’état normal, l’apoprotéine opsine et le rétinal 11-cis (11c), un dérivé de la vitamine A, se lient pour former la rhodopsine (Rho). Le rétinal 11-cis agit comme agoniste inverse et l’activité intrinsèque de l’apoprotéine se trouve donc réduite. En présence de lumière, le rétinal 11-cis se photo-isomérise en rétinal tout-trans (at), ce qui conduit à l’activation de la rhodopsine. L’absorption du photon par la rhodopsine active une protéine G, la transducine (Td) entraînant le processus de phototransduction avec signal électrophysiologique passant à travers la membrane des cellules photoréceptrices. En présence de RPE65, le rétinal tout-trans est réisomérisé en rétinal 11-cis qui est réincorporé à l’opsine pour reconstituer la rhodopsine. Mais, dans le cas de LCA2, en l’absence de RPE65, l’opsine continue à activer la transduction, et les photorécepteurs, soumis à une activité faible, mais continue, sont détruits, qu’ils soient ou non exposés à la lumière (Figure 2). 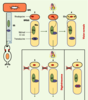 | Figure 2.Fonctionnement des photorécepteurs. (1) Le segment externe des photorécepteurs (OS) reçoit la lumière. RPE : réticulum endoplasmique. (2) La rhodopsine (Rho) des bâtonnets est obtenue par la liaison d ’une molécule d’opsine avec une molécule de rétinal 11-cis (vert-11c), mais en l’absence de lumière, la rhodopsine n’active pas la protéine G transducine (bleu-Td). (3) Sous l’action de la lumière, la transformation du rétinal 11-cis en tout-trans (at : all-trans) induit l’association de la rhodopsine avec la transducine et la cascade de la phototransduction. Le chromophore est transporté dans l’épithélium rétinien. (4) En présence de RPE65, le rétinal tout-trans est réisomérisé en 11-cis et réincorporé dans l’opsine pour reconstituer la rhodopsine. (5) En l’absence de RPE65, l’opsine n’est pas liée et active faiblement mais continûment la transduction. (6) Les photorécepteurs meurent, qu’ils soient ou non exposés à la lumière (chez la souris Rpe65 −/−, et chez l’homme dans la LCA). (7) La suppression du gène codant pour la transducine empêche la dégénérescence des photorécepteurs (chez les souris Rpe65 −/−/Gnat −/−, doublement invalidées) (d’après [
7]). |
Chez la souris Rpe65−/−, qui est un modèle pour LCA2, les résultats obtenus confirment tous l’hypothèse de l’effet destructeur de l’activité permanente de l’opsine .
-
Par rapport à des souris témoins, l’amplitude et la sensibilité de la réponse à la lumière des bâtonnets des souris Rpe65−/− sont diminuées. Les canaux dépendant du GMPc ont conservé une fonction normale.
-
Comme l’atteste l’examen des coupes histologiques de rétine, la suppression de la transducine protège les souris Rpe65−/− de la dégénérescence rétinienne : les doubles mutantes Rpe65−/−/ Gnat−/− ont un épithélium indemne, identique à celui des souris témoins.
-
La dégénérescence est indépendante de l’exposition à la lumière : à 28 semaines de vie, la diminution de la couche nucléaire externe, chez des souris Rpe65−/− élevées dans l’obscurité, est identique à celle observée chez des souris Rpe65−/− élevées au jour.
-
Actuellement, on ignore encore si ce sont les quantités très diminuées de calcium dans le segment externe qui ont le pouvoir d’induire l’apoptose.
|
Le rôle pathogène de l’opsine non liée Ainsi, les photorécepteurs des souris Rpe65−/− sont soumis à un phénomène ambigu : du fait de la très faible quantité de rhodopsine, ils sont protégés contre les fortes expositions de lumière, mais l’activité de l’opsine, correspondant à une exposition faible en permanence, entraîne une dégénérescence irréversible. Le phénomène est d’autant plus intéressant que les souris Rpe65−/− sont aussi un modèle pour la carence en vitamine A dans laquelle les bâtonnets, privés de rétinal mais contenant de l’opsine, subissent aussi une dégénérescence. C’est la première fois qu’un tel mécanisme physiopathologique est démontré en pathologie humaine : en l’absence de mutation, un trouble fonctionnel d’un récepteur couplé à une protéine G est capable de produire des lésions. Il sera intéressant de rechercher si d’autres récepteurs couplés à des protéines G peuvent également être à l’origine de maladies humaines. |
1. Kaplan J, Rozet J, Gerber S, et al. Des gènes pour les dystrophies rétiniennes des enfants. Med Sci (Paris)1995; 11 : 325–35. 2. Cremers FPM, van den Hurk JAJM, den Hollander AI. Molecular genetics of Leber congenital amaurosis. Hum Mol Genet 2002; 11 : 1169–76. 3. Perrault I, Rozet JM, Calvas P, et al. Retinal specific guanylate cyclan gene mutations in Leber’s congenital amaurosis. Nat Genet 1996; 14 : 461–4. 4. Hamel C, Marlhens F. Des mutations de gènes contrôlant le métabolisme des rétinoïdes 11-cis responsables de dystrophies rétiniennes sévères. Med Sci (Paris) 1998; 14 : 754–7. 5. Wooruff ML, Wang Z, Chung HY, et al. Spontaneous activity of opsin apoprotein is a cause of Leber congenital amaurosis. Nat Genet 2003; 35 : 158–64. 6. Agurirre GD, Baldwin V, Pearcez-Kelling S, et al. Congenital stationary night blindness in the dog : common mutation in the RPE65 gene indicates founder effect. Mol Vision 1998; 4 : 23. 7. Remé CE, Wenzel A. The dangers of seeing light in the dark. Nat Genet 2003; 35 : 115–6. |