| |
| Med Sci (Paris). 2004 February; 20(2): 225–230. Published online 2004 February 15. doi: 10.1051/medsci/2004202225.Contrôle du mouvement du regard (2) Imagerie fonctionnelle cérébrale des saccades volontaires Marie-Hélène Grosbras,*1 Élie Lobel,2 and Alain Berthoz2 1Département de neuropsychologie, Institut et Hôpital neurologique de Montréal, 3801, rue University, Montréal, Québec H3A 2B4, Canada 2LPPA, Collége de France, 11, place Marcelin-Berthelot, 75005 Paris, France |
Les saccades sont l’un des mouvements oculaires (→) qui permettent d’amener et de maintenir l’image d’un objet sur la fovéa de la rétine. Elles peuvent être réflexes, vers un stimulus qui apparaît brusquement, ou volontaires permettant de sélectionner la partie précise de la scène visuelle qui sera (ou ne sera pas) amenée sur la fovéa. Alors que ces deux types de saccades partagent les mêmes voies d’exécution (commande des muscles oculomoteurs) dans le tronc cérébral, les voies supérieures de contrôle diffèrent, quant à elles, suivant le type de saccades. Cet article décrit les progrès réalisés grâce à la tomographie par émission de positons (TEP) et l’imagerie par résonance magnétique fonctionnelle (IRMf) pour dresser une carte anatomofonctionnelle précise des circuits impliqués dans le contrôle des saccades volontaires chez l’homme. Ces deux techniques sont sensibles aux variations locales de débit sanguin produites par l’activité neuronale et fournissent donc une mesure indirecte de l’activité neuronale, avec une résolution spatiale de l’ordre du millimètre. Les données recueillies représentant une mesure relative de l’activité cérébrale, on analyse toujours celle-ci par rapport à une condition de base.
(→) m/s 2004, n°1, p.90
|
Saccades volontaires simples dans l’obscurité Les saccades dans l’obscurité permettent d’étudier les circuits neuronaux impliqués dans la production volontaire de saccades, indépendamment des effets dus à la stimulation visuelle. La TEP et l’IRMf ont permis de déterminer la localisation des trois régions oculomotrices principales identifiées par les études de lésions [
1–
3] (Figure 1) : les champs oculomoteurs frontaux (COF), les champs oculomoteurs supplémentaires (COS) et, dans une moindre mesure, le cortex pariétal postérieur. En outre, une activation du cortex occipital est souvent observée.
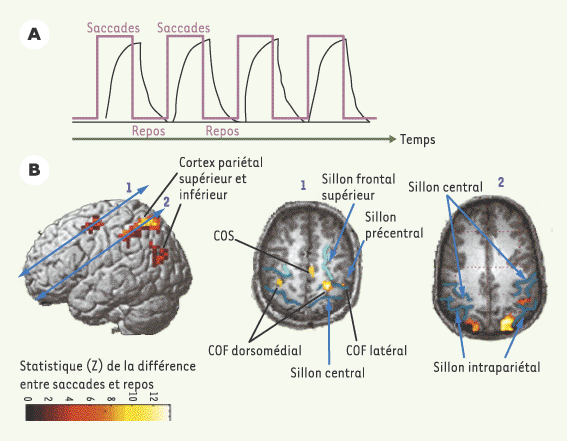
 | Figure 1.
Imagerie par résonance magnétique fonctionnelle (IRMf). A. Protocole expérimental. Des périodes de 30 secondes pendant lesquelles le sujet fait des saccades alternent avec des périodes de 30 secondes de repos (tracé en rose). La réponse hémodynamique dans une région cérébrale donnée est plus intense pendant les saccades que pendant le repos (tracé en noir). B. Activation cérébrale pendant l’exécution de saccades dans le noir. L’échelle de couleur représente la valeur du test statistique effectué (probabilité que le signal recueilli soit différent dans la condition de saccades par rapport à la condition de repos). Seuls les points de l’image où cette probabilité est supérieure à 95 % sont représentés. La vue de gauche est une reconstruction tridimensionnelle du cerveau ; les deux autres vues sont des coupes antéropostérieures passant respectivement par les flèches 1 et 2. COF : champ oculomoteur frontal ; COS : champ oculomoteur supplémentaire. Les sillons sont dessinés en bleu. |
De plus, l’IRMf à haut champ a permis de distinguer deux foyers d’activation dans la région du COF [
5–
7] : le COF dorsomédian et le COF latéral (Figure 1). Cette observation a été confirmée par des études de stimulation intracorticale menées en parallèle dans un contexte clinique [7]. Ce résultat est à rapprocher des études qui ont montré que plusieurs régions oculomotrices coexistent dans le lobe frontal du primate. Une question encore en suspens est celle de l’origine et de la fonction d’une telle redondance des représentations oculomotrices : est-elle liée à l’utilisation de différents systèmes de coordonnées ou à la coordination avec d’autres mouvements ? L’analyse des données individuelles d’IRMf permet d’établir des corrélations anatomofonctionnelles pouvant permettre de localiser une aire fonctionnelle dans un contexte de recherche, de diagnostic neurologique ou encore de neurochirurgie. De façon extrêmement reproductible, à la fois dans plusieurs études d’IRMf [
4–
6] et dans une étude de stimulation intracorticale [7], le COF dorsomédian se situe dans la partie profonde du sillon précentral, au niveau de la jonction avec le sillon frontal supérieur (Figure 2), zone qui constitue un point de repère constant dans le cerveau humain [
8]. Ces deux sillons appartiennent aux « racines sulcales », c’est-à-dire aux sillons se développant entre les 2e et 7e mois de vie fœtale, et considérés comme des repères fondamentaux du cerveau humain résultant de la maturation des aires corticales primaires [
9]. Cette considération est en accord avec l’idée que le COF dorsomédian identifié ici serait l’équivalent d’une aire « primaire » du contrôle oculomoteur.
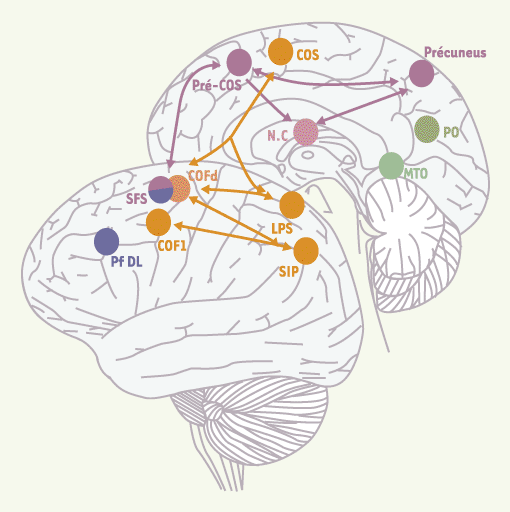
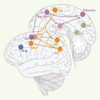 | Figure 2.
Schéma récapitulatif des circuits oculomoteurs corticaux. En orange : régions oculomotrices principales. En rose : régions additionnelles activées lors de l’exécution de mémoire de séquences de saccades nouvelles. En bleu : régions activées lors de saccades mémorisées. En vert : régions activées pour les séquences de saccades familières. COF : champs oculomoteurs frontaux ; COS : champs oculomoteurs supplémentaires ; Pf DL : cortex préfrontal dorsolatéral ; SIP : sillon intrapariétal ; SFS : sillon frontal supérieur ; LPS : lobule pariétal supérieur ; NC noyau caudé (vue en transparence) ; PO : occipito-temporal ; MTO : temporo-occipital médian. |
Concernant le COS, un repère a été identifié à l’extrémité d’un sillon de la surface interhémisphérique, le sillon paracentral [6]. Ce sillon, relativement variable dans sa forme et sa localisation, ne fait pas partie des racines sulcales. Concernant le champ oculomoteur pariétal, plusieurs foyers d’activation sont souvent observés chez un même sujet (Figure 1), tous se situant autour du sillon intrapariétal ; il est aujourd’hui encore difficile de déterminer lequel de ces foyers constitue le champ oculomoteur pariétal principal. Il semble qu’à l’image du lobe frontal, le cortex pariétal postérieur soit subdivisé en unités liées chacune à un type d’action dans un système de coordonnées. La représentation de l’action s’organiserait en impliquant des modules constitués chacun d’une aire frontale et d’une aire pariétale connectées anatomiquement et fonctionnant pour contrôler un type d’action [
10]. Chez l’homme on peut imaginer que chacun des COF (dorsomédial et latéral) ait un binôme dans le cortex pariétal et que les deux paires ainsi constituées fonctionnent en parallèle. Des études plus fines de connectivité fonctionnelle sont nécessaires pour élucider ce point. |
Saccades et traitement visuospatial Saccades volontaires et déplacement de l’attention D’une façon générale, le COF, le COS et le cortex pariétal sont activés lors de déplacements volontaires de l’attention, qu’il y ait ou non mouvement des yeux, c’est-à-dire lorsque l’on demande au sujet de s’imaginer, mais sans l’exécuter, une saccade oculaire [ 4,
11] : les déplacements de l’attention seraient donc des saccades bloquées à des niveaux inférieurs d’exécution. Ce résultat traduit une caractéristique générale de l’organisation des systèmes moteurs puisque, de façon similaire, l’imagination d’un mouvement squelettique active les mêmes régions que sa réalisation ; cela serait rendu possible par le développement, au cours de l’évolution, de mécanismes d’inhibition permettant un verrouillage de l’action, offrant ainsi au cerveau la possibilité de simuler l’action sans l’exécuter, afin notamment d’en évaluer les conséquences [
12]. Ce phénomène met également en avant le rôle du circuit oculomoteur dans la sélection spatiale des informations d’intérêt : ainsi, l’exploration visuelle est indissociable du contrôle oculomoteur et repose sur des mécanismes complexes de sélection et de détection. Saccades volontaires et mémoire de travail spatiale Les saccades dirigées vers l’emplacement mémorisé d’une cible constituent un autre type de saccades volontaires qui impliquent à la fois d’inhiber le mouvement réflexe et de mémoriser ses coordonnées en vue de l’exécution ultérieure. Outre le réseau incluant les COF, les COS et le cortex pariétal postérieur, les saccades mémorisées activent des régions du cortex préfrontal, et en particulier le cortex préfrontal dorsolatéral (PfDL) (Figure 2). Comme cette région est activée lors d’une tâche d’antisaccade (au cours de laquelle le sujet doit inhiber la saccade réflexe et programmer une nouvelle saccade dans la direction opposée à la cible), il est possible que le PfDL soit impliqué dans la suppression des saccades réflexes, ce qui est également suggéré par les études de lésions [
13]. D’une façon générale, cette région occupe probablement une place importante dans la supervision des actions à exécuter. Une autre région, juste en avant du COF dorsomédian, dans le sillon frontal supérieur, intervient dans la mémoire spatiale à court terme [
14,
15]. Elle serait l’équivalent d’une région identifiée chez le singe macaque dans laquelle des neurones sont actifs pendant le maintien en mémoire d’une position spatiale. On ignore encore si ces deux régions préfrontales ont un rôle général dans le contrôle de l’action ou si elles contiennent des sous-régions spécifiques du contrôle oculomoteur. Le fait que des stimulations électriques appliquées dans des régions relativement antérieures au cortex moteur provoquent des réponses oculomotrices [
16,
17] suggère qu’il existe peut-être une représentation spécifique des mouvements des yeux en avant du COF. Ainsi, par leur simplicité de mise en œuvre et d’interprétation, les tests oculomoteurs tels que les saccades mémorisées ou les antisaccades représentent un outil pertinent pour évaluer les fonctions exécutives. |
Contrôle cortical des séquences de saccades L’exploration visuelle volontaire est le plus souvent organisée non pas en saccades unitaires indépendantes, mais en séquences de saccades. Ce trajet oculomoteur dépend non seulement de la scène visuelle, mais aussi des intentions du sujet, c’est-à-dire des questions qu’il se pose à propos de l’environnement qu’il explore [
18]. De plus, les séquences oculomotrices ont sans doute un rôle dans la mémoire et la formation des images mentales. Ainsi, S.A. Brandt et al. [
19] ont montré que les trajets spatiotemporels du regard étaient très similaires dans la condition d’observation et dans la condition d’imagination. Le trajet oculomoteur représenterait donc la réalisation d’une séquence interne issue de la représentation sensorimotrice d’une image ou d’une scène dans le cerveau. L’imagerie fonctionnelle a permis d’explorer l’activité corticale mise en jeu lorsqu’on demande à des sujets de reproduire de mémoire une séquence qu’ils viennent d’effectuer de façon visuellement guidée [
20–
23]. En plus du réseau cortical impliqué dans le contrôle des saccades simples, les séquences de saccades activent un circuit composé principalement du précuneus, d’une région située dans le sillon intrapariétal, d’une région antérieure au COS et d’une région antérieure au COF, située dans le sillon frontal supérieur, qui correspond à un foyer déjà impliqué dans la mémoire spatiale à court terme (voir plus haut) [14] ou dans l’exploration spatiale [15]. Ces régions seraient donc activées spécifiquement dans l’exécution volontaire de séquences de saccades mémorisées, mais pas dans l’exécution de saccades simples (Figure 3).
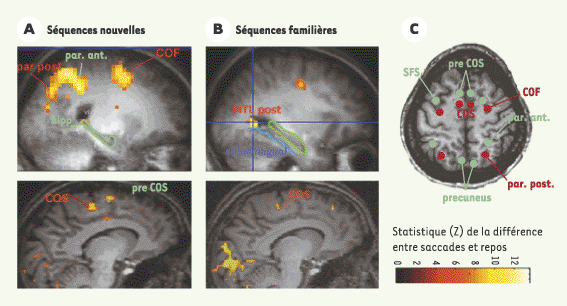
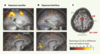 | Figure 3.
Activation cérébrale associée à l’exécution de mémoire de séquences de saccades nouvellement apprises (A) ou familières (B). L’échelle de couleur représente la valeur du test statistique effectué (probabilité que le signal recueilli soit différent dans la condition de saccades par rapport à la condition de repos). Seuls les points de l’image où cette probabilité est supérieure à 95 % sont représentés. Les deux coupes sagittales du haut montrent la dissociation au niveau du lobe médiotemporal. On voit que, pour les séquences nouvelles, une partie de la queue de l’hippocampe (hipp) est activée, tandis que pour les séquences familières, une région plus postérieure du cortex médiotemporal (MTL post) s’active. Les deux coupes sagittales du bas montrent la dissociation au niveau du champ oculomoteur supplémentaire (COS). Pour les séquences nouvelles, deux régions sont activées au niveau de la surface interhémisphérique frontale : une région plus postérieure correspondant au COS, et une région plus antérieure que nous appelons pré-COS. C. Représentation schématique de l’activation commune aux séquences nouvelles et familières en rouge, et l’activation spécifique pour les séquences nouvelles en vert. Notez le recrutement de régions plus antérieures pour les séquences nouvelles. SFS : sillon frontal supérieur ; COF : champ oculomoteur frontal ; par. ant : cortex pariétal antérieur ; par post : cortex pariétal postérieur. |
Le foyer d’activation observé sur la surface interhémisphérique antérieure au COS peut être appelé pré-COS [
22, 23], par analogie avec la dichotomie aire motrice supplémentaire (AMS)/pré-AMS ; celle-ci est en effet activée lors de l’apprentissage de séquences motrices complexes et la sélection libre de mouvements [
24], et son activation décroît lorsque le mouvement ou l’association motrice deviennent « surappris » [
25]. Même si les données actuelles ne permettent pas de dire si la région pré-COS est spécifiquement oculomotrice, quelques études de stimulation intracorticale chez l’homme et chez le primate non humain suggèrent la présence, en avant du COS, d’un champ lié aux saccades. Les séquences de saccades suivent des schémas stéréotypés lorsqu’on observe des objets familiers. Par exemple, pour regarder un visage, le trajet du regard décrit un triangle ayant pour sommets les yeux et la bouche. Il a été suggéré que l’apprentissage procédural d’une séquence donnée, c’est-à-dire sa répétition jusqu’à l’automatisation, puisse modifier l’activation des circuits impliqués dans la mise en œuvre des séquences nouvelles. Des sujets ayant ainsi appris une séquence particulière ont été soumis à des examens par IRMf au cours desquels l’activité cérébrale associée à la reproduction de mémoire de cette séquence familière était comparée à l’activité de repos et à l’activité enregistrée au cours de l’exécution de séquences nouvelles, c’est-à-dire venant d’être mémorisées. Par rapport à la situation de repos, l’exécution de séquences familières ou de séquences nouvelles active les deux COF, les COS et le cortex pariétal postérieur. Probablement en raison d’une plus grande « charge attentionnelle » nécessaire à leur exécution, les séquences nouvelles activent de façon beaucoup plus importante que les saccades simples le réseau de base, à l’exception notable du COF latéral. Ces résultats suggèrent d’une part que les régions préfrontales identifiées lors de l’exécution de séquences nouvelles ne sont pas activées lors de l’exécution de séquences familières, et d’autre part qu’il existe une différence fonctionnelle entre les deux COF activés lors de la réalisation de saccades simples. L’apprentissage poussé d’une séquence particulière ne se traduit-il que par une moindre activation cérébrale ? Ou bien est-il possible d’observer des régions activées spécifiquement lors de l’exécution de séquences à partir d’une mémoire à long terme (ce qui offrirait un corrélat neural à notre capacité à exécuter des séquences de façon stéréotypée) ? Pour les séquences familières, on peut observer une augmentation d’activité dans deux régions restées au repos lors de l’exécution de séquences nouvelles, l’une d’entre elles étant très proche d’un site impliqué dans le codage spatial allocentré1 [
26,
27]. Il est probable que, une fois automatisée, une séquence soit considérée comme une « forme » dans un espace défini par des repères extérieurs à notre corps. |
Les mouvements oculaires volontaires constituent sans doute un exemple paradigmatique de l’utilisation qui peut être faite de l’imagerie cérébrale fonctionnelle dans l’évaluation de l’intégrité de circuits cérébraux. L’étude des tâches de saccades oculaires volontaires présentées ici pourrait-elle aider à caractériser des maladies neuropsychologiques ? Quelques exemples montrent la faisabilité d’une telle approche : K.R. Thulborn et al. [
28] ont observé que des sujets ayant un diagnostic probable d’Alzheimer présentaient une réduction de l’activité du sillon intrapariétal droit ainsi qu’une activité significative dans le cortex préfrontal pour des saccades simples. Il a également été montré que des sujets schizophrènes présentaient une activité oculomotrice comparable aux sujets sains lors de saccades simples, mais un déficit de l’activité du cortex préfrontal dorsolatéral lorsqu’il leur était demandé de réaliser des antisaccades [
29]. Cependant, d’autres résultats mettent plutôt en cause le déficit d’un système frontostriatal d’inhibition des saccades réflexes chez des sujets schizophrènes [
30]. Enfin, l’étude de sujets autistes révèle une activation oculomotrice normale pour les saccades réflexes, mais une absence d’activité pour les saccades impliquant une composante de mémoire spatiale [
31]. |
Footnotes |
1. Law I, Svarer Rostrup E, Paulson OB. Parieto-occipital cortex activation during self-generated eye movements in the dark.Brain 1998; 121: 2189–200. 2. Petit L, Orssaud C, Tzourio N, Salamon G, Mazoyer B, Berthoz A. PET study of saccadic eye movements in humans : basal ganglia-thalamocortical system and cingulate cortex involvement. J Neurophysiol 1993; 69 : 1009–17. 3. Dejardin S, Dubois S, Bodart JM, et al. PET study of human voluntary saccadic eye movements in darkness : effect of task repetition on the activation pattern. Eur J Neurosci 1998; 10 : 2328–36. 4. Beauchamp MS, Petit L, EllmoreTM, IngeholmJ, Haxby JV. A parametric fMRI study of overt and covert shifts of visuospatial attention. Neuroimage 2001; 14 : 310–21. 5. Luna B, Thulborn KR, Strojwas MH, et al. Dorsal cortical regions subserving visually guided saccades in human : an fMRI study. Cereb Cortex 1998; 8 : 40–7. 6. Grosbras MH, Lobel E, van de Moortel PF, Le Bihan D, Berthoz A. An anatomical landmark for the supplementary eye field revealed with fMRI.Cereb Cortex 1999; 9 : 705–11. 7. Lobel E, Kahane P, Leonards U, et al. Localization of the human frontal eye fields : anatomical and functional findings from fMRI and intracerebral electrical stimulation. J Neurosurg 2001; 95 : 804–15. 8. Ono M, Kubik S, Abernathey CD. Atlas of the cerebral sulci. Stuttgart : Georg Thieme Verlag, 1990 : 218 p. 9. Regis J, Mangin JF, Frouin V, Sastre S, Peragut JC, Samson Y. Generic model for the localization of the cerebral cortex and preoperative multimodal integration in epilepsy surgery. Stereoctact Funct Neurosurg 1995; 65 : 72–80. 10. Rizzolatti G, Luppino G, Matelli M. The organization of the cortical motor system : new concepts. Electroencephalograph Clin Neurophysiol 1998; 106 : 283–96. 11. Corbetta M, Akbudak E, Conturo TE, et al. A common network of functional areas for attention and eye movements. Neuron 1998; 21 : 761–73. 12. Berthoz A. Le sens du mouvement. Paris : Odile Jacob, 1997 : 370 p. 13. Pierrot-Deseilligny C, Rivaud S, Gaymard B, Müri R, Vermersch AI. Cortical control of saccades. Ann Neurol 1995; 37 : 557–67. 14. Courtney SM, Petit L, Maisog JA, Ungerleider LG, Haxby JV. An area specialized for spatial working memory in human frontal cortex. Science 1998; 279 : 1347–50. 15. Leonards U, Sunaert S, Van Hecke P, Orban GA. Attention mechanisms in visual search : an fMRI study. J Cogn Neurosci 2000; 12 : 61–75. 16. Blanke O, Spinelli L, Thut G, et al. Location of the human frontal eye field as defined by electrical cortical stimulation : anatomical, functional and electrophysiological characteristics. Neuro Report 2000; 11 : 1907–13. 17. Rasmussen T, Penfield W. Movements of the head and eyes from stimulation of the human frontal cortex. Res Publ Assoc Res Nerv Ment Dis 1948; 27 : 346–61. 18. Yarbus AL. Eye movements and vision. New York : Plenum Press, 1967. 19. Brandt SA, Stark LW. Spontaneous eye movements during visual imagery reflect the content of the visual scene. J Cogn Neurosci 1997; 9 : 27–38. 20. Kawashima R, Tanji J, Okada K, et al. Oculomotor sequence learning : a positron emission tomography study. Exp Brain Res 1998; 122 : 1–8. 21. Petit L, Orssaud C, Tzourio N, Crivello F, Berthoz A, Mazoyer B. Functional anatomy of a prelearned sequence of horizontal saccades in humans. J Neurosci 1996; 16 : 3714–36. 22. Grosbras MH, Leonards U, Lobel E, Poline JB, Le Bihan D, Berthoz A. Human cortical networks for new and familiar sequences of saccades. Cereb Cortex 2001; 11 : 936–45. 23. Heide W, Binkofski F, Seitz RJ, et al. Activation of frontoparietal cortices during memorized triple-step sequences of saccadic eye movements : an fMRI study. Eur J Neurosci 2001; 13 : 1177–89. 24. Hikosaka O, Sakai K, Mikauchi S, Takino R, Sasaki Y, Putz B. Activation of human pre-supplementary motor area in learning of sequential procedures : a functional MRI study. J Neurophysiol 1996; 76 : 617–21. 25. Sakai K, Hikosaka O, Miyauchi S, Takino R, Sasaki Y, Putz B. Transition of brain activation from frontal to parietal areas in visuomotor sequence learning. J Neurosci 1998; 18 : 1827–40. 26. Ghaem O, Mellet E, Crivello F, et al. Mental navigation along memorized routes activates the hippocampus, precuneus, and insula. NeuroReport 1997; 8 : 739–44. 27. Ploner CJ, Gaymard BM, Rivaud-Pechoux S, et al. Lesions affecting the parahippocampal cortex yield spatial memory deficits in humans. Cereb Cortex 2000; 10 : 1211–6. 28. Thulborn KR, Martin C, Voyvodic JT. Functional MR imaging using a visually guided saccade paradigm for comparing activation patterns in patients with probable Alzheimer’s disease and in cognitively able elderly volunteers. Am J Neuroradiol 2000; 21 : 524–31. 29. McDowell JE, Brown GG, Paulus M, et al. Neural correlates of refixation saccades and antisaccades in normal and schizophrenia subjects. Biol Psychiatry 2002; 51 : 216–23. 30. Raemaekers M, Jansma JM, Cahn W, et al. Neuronal substrate of the saccadic inhibition deficit in schizophrenia investigated with 3-dimensional event-related functional magnetic resonance imaging. Arch Gen Psychiatry 2002; 59 : 313–20. 31. Luna B, Minshew NJ, Garver KE, et al. Neocortical system abnormalities in autism : an fMRI study of spatial working memory. Neurology 2002; 59 : 834–40. |