Depuis une décennie, P.E. Nielsen et son équipe danoise ont développé des analogues d’oligonucléotides, les PNA (peptide nucleic acid) dans lesquels la chaîne phosphodiester de l’ADN a été remplacée par une chaîne pseudo-peptidique polyamidique sur laquelle sont attachées les nucléobases [ 1]. Ces molécules chimères, qui ne sont ni des peptides, ni des acides nucléiques, s’apparient aux polymères d’acides nucléiques en formant les paires de bases classiques (Figure 1). La nature atypique du squelette des PNA leur confère de nombreux avantages par rapport aux autres analogues de l’ADN. L’absence de charges dans leur squelette conduit à la formation de complexes extraordinairement stables avec l’ADN et l’ARN.
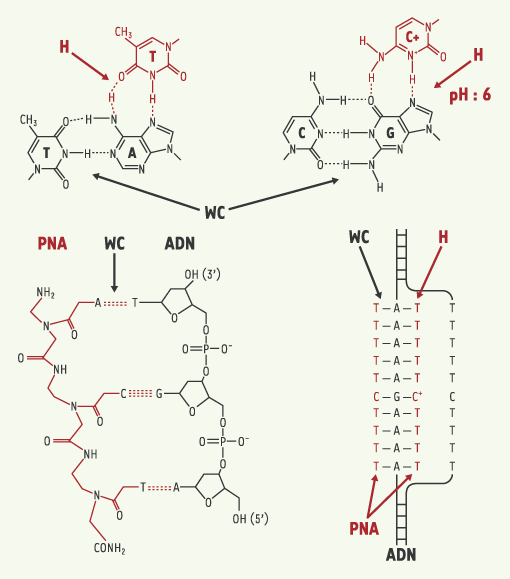
| Figure 1.
Structure des complexes PNA-ADN. Le PNA est une molécule synthétique dans laquelle le squelette sucre-phosphate de l’ADN a été remplacé par un squelette polyamide composé d’unités aminoéthylglycine sur lesquelles les nucléobases ont été attachées par une liaison méthyle carbonyle. L’hybridation du PNA aux acides nucléiques obéit aux règles classiques de l’appariement des bases : l’adénine est reconnue par la thymine et la guanine par la cytosine. Les liaisons hydrogène de type Watson-Crick sont impliquées dans la formation du duplex. Les bases pyrimidiques du PNA peuvent former des liaisons hydrogène de type Hoogsteen avec les bases puriques de l’ADN. Le PNA forme un complexe PNA-ADN-PNA avec le brin polypurique et induit le déplacement de l’autre brin de l’ADN. L’un des PNA du triplex forme des liaisons Watson-Crick (WC) avec l’ADN, l’autre des liaisons Hoogsteen (H). |
Les PNA ont une très grande affinité pour les ARN et peuvent se fixer sur des ARN messagers très fortement structurés [ 2]. Cette forte affinité s’accompagne aussi d’une très grande sélectivité puisqu’une courte séquence de PNA dirigée contre le messager de l’oncogène Ha-ras inhibe la traduction de ce dernier, alors que l’expression du messager sauvage n’est que très faiblement affectée [ 3]. N’étant pas reconnus par les protéases ni par les nucléases, les PNA sont très stables dans les milieux biologiques. Ces propriétés des PNA sont déjà amplement exploitées pour moduler l’expression des gènes in vitro et pourraient être ainsi utilisées dans le domaine de la pharmacothérapie anticancéreuse ou antimicrobienne. Ainsi, in vitro, l’ajout à des cellules immortalisées de PNA complémentaires de la composante ARN de la télomérase inhibe l’activité de l’enzyme, induit un raccourcissement des télomères et provoque un arrêt de la prolifération cellulaire [ 4]. Les PNA inhibent aussi efficacement l’activité enzymatique des transcriptases inverses de virus murins, aviaires ou du VIH [ 5]. Les PNA ont été ciblés sur plusieurs régions stratégiques de l’ARN ribosomique 16S d’E. coli pour inhiber la traduction totale des ARN messagers bactériens [ 6]. L’interaction des PNA avec l’ADN double brin implique la formation de complexes PNA-ADN-PNA. Un des PNA se lie à l’ADN cible par des liaisons hydrogène classiques Watson-Crick alors que l’autre interagit par des liaisons hydrogène de type Hoogsteen (Figure 1). Les deux molécules de PNA impliquées dans ce triplex peuvent êtres reliées par un bras flexible pour former des PNA pinces (Figure 2). Une fois formés, les complexes PNA-ADN ou PNA-ADN-PNA sont extrêmement stables.
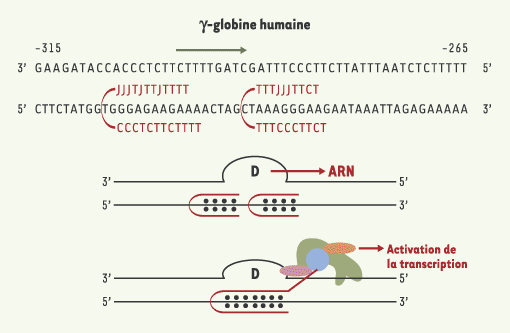
| Figure 2.
Les PNA-pinces. Pour augmenter l’efficacité de la fixation des PNA à l’ADN, des PNA-pinces dans lesquels deux PNA sont reliés par un bras flexible sont utilisés. En général, les cytosines sont remplacées par des pseudoisocytosines (les bases J) afin de rendre leur fixation indépendante du pH. Ces bases portent un atome d’hydrogène en position N3, leur appariement Hoogsteen avec les guanines ne requiert plus une protonation à pH acide. La boucle formée par le brin de l’ADN déplacé (boucle D) après fixation du PNA-pinces est reconnue comme une structure qui peut initier la transcription d’un gène. La fixation de deux PNA-pinces dans une région située en amont du gène de la γ-globine a permis d’induire in vitro et dans les cellules l’expression de la γ-globine [
7]. Le couplage d’une PNA-pince à un peptide permet de recruter à un site spécifique de l’ADN des facteurs de transcription qui interagissent avec le peptide. |
L’interaction d’un PNA avec l’ADN peut créer un promoteur artificiel et induire l’expression du gène ciblé. Le brin ADN libéré par la fixation du PNA en triplex sur l’autre brin forme une boucle qui est reconnue par l’ARN polymérase qui déclenche la transcription à ce site. Cette stratégie a été utilisée pour induire l’expression de la γ-globine dans les cellules de la lignée cellulaire érythroleucémique K562 (Figure 2) [7]. Cet exemple illustre bien le fait que dans des conditions salines physiologiques, les PNA sont capables de se fixer sur leurs cibles dans le chromosome et d’induire la transcription. Cette approche pourrait être appliquée à la thérapie des maladies génétiques fréquentes causées par des mutations du gène codant pour la β-globine (drépanocytose, b-thalassémie).
La structure du complexe formé par le PNA et l’ADN peut aussi être reconnue comme une lésion de l’ADN à réparer. Des PNA pinces induisent des mutations ponctuelles ou des délétions et insertions de bases uniques dans la séquence ciblée, ou à cinq paires de bases du site [ 8]. Une recombinaison ciblée peut être induite, en couplant un PNA pince à un fragment d’ADN homologue à la région adjacente au site de fixation du PNA [ 9]. L’enthousiasme initial suscité par les caractéristiques physico-chimiques tout à fait remarquables des PNA a été tempéré par les problèmes rencontrés pour faire pénétrer ces molécules dans les cellules de mammifères. En effet, l’utilisation des PNA in vivo est limitée car ces molécules ne pénètrent pas dans les cellules en culture, à moins de les utiliser à des concentrations très importantes. Cependant, il a été montré ex vivo et in vivo que contrairement aux autres types cellulaires, les cellules neuronales étaient perméables aux PNA et que ces derniers pouvaient franchir la barrière hémato-encéphalique [ 10]. La liaison covalente de vecteurs appropriés à des PNA permet leur pénétration dans d’autres types cellulaires. Ainsi, le peptide de signalisation nucléaire dérivé de l’antigène T du virus SV40 (NLS, nuclear localization sequence) a été utilisé pour délivrer un PNA dirigé contre l’oncogène c-myc dans les cellules de lymphomes de Burkitt [ 11]. Les PNA ont été aussi couplés à des peptides positivement chargés, comme certains domaines de la protéine Tat du virus VIH ou de la protéine Antennapedia de la drosophile [ 12]. En présence de lipides cationiques, la transfection de cellules leucémiques promyélocytaires humaines en culture avec des PNA portant un groupement lipophile et dirigés contre le messager codant pour la protéine de fusion PML/RARa induit une inhibition complète de l’expression de cet oncogène [ 13]. Des PNA conjugués à la dihydrotestostérone ont été ciblés dans des cellules de carcinome de prostate et ont permis d’inhiber sélectivement l’expression de l’oncogène myc [ 14]. Des données récentes montrent que chez la souris, parmi les oligonucléotides de même séquence, mais de compositions chimiques différentes, administrés par voie intrapéritonéale, l’activité antisens la plus forte, dans les différents tissus testés, a été induite par les PNA conjugués à quatre lysines [ 15].
Le coût élevé de la synthèse des PNA va probablement diminuer si les travaux futurs confirment l’intérêt de l’utilisation des PNA in vivo.