| |
| Med Sci (Paris). 2004 January; 20(1): 89–97. Published online 2004 January 15. doi: 10.1051/medsci/200420189.Contrôle du mouvement du regard (1) Le rôle du cortex pariétal Claire Wardak and Jean-René Duhamel* Institut des Sciences Cognitives, Cnrs, 67, boulevard Pinel, 69675 Bron, France |
Le regard possède un rôle essentiel dans nos interactions avec l’environnement : il permet de nous représenter notre environnement et notre position dans celui-ci, et est également nécessaire pour fixer un objet que l’on veut analyser correctement. Le regard, défini comme le point de fixation des deux yeux, se déplace grâce aux mouvements des yeux ou aux mouvements combinés des yeux et de la tête. Le point de fixation est fonctionnellement important du fait de l’organisation de la rétine. En effet, la majorité des récepteurs visuels est concentrée au centre de la rétine : la fovéa. Dans les aires corticales visuelles primaires, la partie du champ visuel correspondant à la fovéa est surreprésentée par rapport à celle correspondant à la périphérie. Par conséquent, pour analyser un objet dans un but d’identification et d’action (le saisir, l’éviter…), il est nécessaire de placer cet objet sur la fovéa. Ainsi, les mouvements des yeux refléteraient indirectement le comportement et les intentions d’un individu. Les mouvements oculaires volontaires sont de trois types : saccades, poursuite et vergence (voir Encadré). Ces mouvements sont permis par des réseaux impliquant de nombreuses structures corticales et sous-corticales. Au sein de ces réseaux, le cortex pariétal est un carrefour stratégique entre les structures impliquées dans la perception visuelle et celles participant à l’élaboration des commandes motrices nécessaires au déplacement des yeux. |
Méthodes d’étude de l’implication du cortex pariétal dans les mouvements des yeux Plusieurs méthodes ont été utilisées pour relier une localisation anatomique à une fonction comportementale. Chez l’animal, deux méthodes sont principalement mises en œuvre : l’électrophysiologie extracellulaire et les lésions. Le principe de l’électrophysiologie extracellulaire est d’enregistrer l’activité électrique d’un neurone (potentiel d’action) en réponse à une stimulation visuelle ou à une action particulière de l’animal (par exemple, apparition d’un objet visuel à un endroit précis de l’espace ou réalisation d’une saccade). Le principe des lésions est quant à lui d’évaluer les déficits comportementaux engendrés par la lésion d’une région précise. La méthode lésionnelle anciennement utilisée, généralement par aspiration, présente plusieurs inconvénients : l’aire à léser doit être repérée de manière anatomique, l’étendue de la lésion est difficile à contrôler et des phénomènes de plasticité cérébrale conduisent à une réorganisation des réseaux fonctionnels et donc à une récupération des déficits, très rapide mais variable dans le temps et en qualité. C’est pourquoi, plus récemment, une technique d’inactivation contrôlée et réversible a été développée. Elle peut être réalisée soit par un agent chimique (injection intracérébrale d’une molécule inhibitrice dans des zones repérées par électrophysiologie), soit par le froid (implantation de tuyaux dans lesquels passent un liquide réfrigérant).

Chez l’homme, la neuropsychologie et l’imagerie cérébrale fonctionnelle ont apporté des réponses quant au rôle du cortex pariétal dans les mouvements des yeux. La neuropsychologie utilise le même raisonnement que la méthode lésionnelle chez l’animal : il s’agit de l’observation du comportement de patients porteurs de lésions cérébrales (généralement secondaires à un accident vasculaire cérébral) dans des tâches particulières. Les limites de ces études sont la taille des lésions, souvent étendues, et l’absence de reproductibilité (en taille et en localisation) d’un patient à l’autre. L’imagerie cérébrale fonctionnelle est un outil plus récent. Son principe repose sur le postulat selon lequel, lorsqu’une partie du cerveau « travaille », le débit sanguin local et la consommation de glucose augmentent. L’imagerie par résonance magnétique fonctionnelle et la tomographie par émission de positons permettent de visualiser ces modifications locales du fonctionnement cérébral lors de la réalisation de tâches utilisant la fonction à étudier. La résolution spatiale de ces techniques d’imagerie est d’environ 1 mm. |
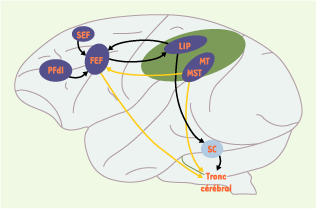
Réseaux des mouvements oculaires chez le singe Les saccades et la poursuite oculaires ne sont pas gérées par les mêmes réseaux (Figure 1). Il est à noter que, pour les structures visuelles, l’hémisphère gauche représente l’espace visuel droit et inversement. 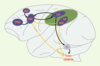 | Figure 1.
Réseaux corticaux gauches pour la production de saccades et de la poursuite oculaire chez le macaque Rhésus. Le cortex pariétal postérieur est représenté en vert. En bleu foncé, sont figurées les aires corticales participant aux mouvements oculaires, en bleu clair une structure sous-corticale participant aux saccades. Les flèches entre les différentes structures représentent les principales connexions anatomiques qui permettent la constitution d’un réseau fonctionnel pour la réalisation des saccades (en noir) et de la poursuite oculaire (en jaune). FEF : frontal eye field ; LIP : aire latérale intrapariétale ; MT : aire temporale médiane ; MST : aire temporale supérieure mésiale ; PFdl : cortex préfrontal dorsolatéral ; SC : colliculus supérieur ; SEF : supplementary eye field. |
Réseau saccadique Trois structures possèdent des neurones dont l’activité peut être reliée aux saccades oculaires : une structure sous-corticale (colliculus supérieur) et deux régions corticales, frontale (champ oculaire frontal, frontal eye field) et pariétale (aire latérale intrapariétale). Les colliculus supérieurs (droit et gauche) possèdent plusieurs couches de cellules, avec une représentation de l’espace controlatéral (opposé) au colliculus enregistré. Les couches dorsales contiennent principalement des neurones qui répondent à l’apparition de stimulus visuels dans certaines parties de l’espace [
1] ; cette région de l’espace est appelée champ récepteur du neurone1. Ces couches dorsales pourraient intégrer l’information venant de la réalisation des saccades pour assurer une constance des représentations et de la perception de notre espace environnant. Les couches ventrales contiennent des cellules qui deviennent actives juste avant la réalisation d’une saccade vers une région précise de l’espace [1] ; cette région est appelée champ de mouvement1. La stimulation électrique d’un neurone provoque une saccade vers ce point de l’espace [
2]. Ces couches dites « motrices » du colliculus supérieur sont directement reliées à la région du tronc cérébral contenant les groupes de neurones codant pour les dernières étapes de la commande vers les muscles de l’œil [
3]. Dans le cortex frontal, le champ oculaire frontal possède des cellules visuelles, des cellules de mouvement et des cellules visuomotrices [
4]. Les premières, sensorielles, répondent à l’apparition d’un stimulus visuel dans leur champ récepteur. Les secondes, plutôt motrices, s’activent avant la réalisation d’une saccade ; elles n’ont pas de réponse purement visuelle (la saccade peut avoir lieu dans le noir). Les troisièmes possèdent les deux types de caractéristiques. La stimulation des cellules de mouvement et des cellules visuomotrices provoque une saccade vers l’emplacement du champ de mouvement de la cellule. D’autres aires frontales jouent un rôle dans les saccades oculaires : le champ oculaire supplémentaire (supplementary eye field) et le cortex préfrontal dorsolatéral. Le supplementary eye field participerait à l’émergence de saccades vers une position particulière de l’espace, indépendamment du point de départ de l’œil, ainsi qu’au codage de l’information motrice pour des tâches faisant l’objet d’un entraînement [
5]. Le cortex préfrontal dorsolatéral serait impliqué dans la mémorisation spatiale des cibles vers lesquelles une saccade va être réalisée [
6]. Dans le cortex pariétal, les neurones de l’aire latérale intrapariétale ont des propriétés visuelles (ils répondent à l’apparition d’un objet dans le champ récepteur) et des propriétés saccadiques (ils répondent avant et/ou pendant la réalisation d’une saccade vers une position particulière) [
7]. L’aire latérale intrapariétale possède une représentation de l’espace controlatéral topographique mais avec une surreprésentation de l’espace central [
8]. Cette aire reçoit des informations provenant de différentes aires du traitement visuel et projette à son tour des informations vers le frontal eye field et le colliculus supérieur [
9]. La lésion de cette région pariétale ne donne pas de déficits saccadiques très nets. Les lésions mécaniques du cortex pariéto-occipital induisent une faible augmentation de la latence des saccades (temps nécessaire au déclenchement du mouvement des yeux après apparition de la cible), sans déficit de perception visuelle [
10]. Par ailleurs, la technique d’inactivation réversible par l’injection de muscimol, agoniste GABAergique, dans l’aire latérale intrapariétale met en évidence [
11] ou non [
12] des déficits mineurs de latence et de précision des mouvements saccadiques. Ces observations suggèrent que l’aire latérale intrapariétale n’est pas indispensable à la réalisation correcte de saccades oculaires, bien que certains auteurs lui attribuent un rôle dans le codage de l’intention motrice de réaliser une saccade vers un endroit particulier [
13]. Cependant, des études montrent que la réponse visuelle des neurones de l’aire latérale intrapariétale est modifiée lorsque l’attention de l’animal est dirigée vers un objet qu’il ne regarde pas (donc sans mouvement des yeux) [7]. L’aire latérale intrapariétale pourrait donc avoir un rôle dans les mécanismes attentionnels (voir plus loin). Poursuite oculaire Dans le cortex frontal, le frontal eye field participe à la formation du signal de poursuite [
14]. Des études récentes montrent que les activités saccadiques et les activités de poursuite du frontal eye field sont séparées et que ce champ pourrait être composé de plusieurs sous-parties [
15]. Dans le cortex pariétal, deux aires extrastriées sont concernées : l’aire temporale médiane et l’aire temporale supérieure mésiale, situées à la limite du cortex pariétal postérieur. Les neurones de ces deux aires répondent à des stimulus visuels en mouvement et sont donc actifs lors de tâches de poursuite [
16]. Ces régions font partie des aires de traitement de l’information visuelle. Elles projettent vers le frontal eye field et vers le tronc cérébral [
17]. Des lésions chimiques (injection d’acide iboténique) dans les aires temporale médiane et temporale supérieure mésiale n’affectent pas la détection et la réalisation de saccade vers des cibles stationnaires (fixes dans l’espace et le temps) [
18]. En revanche, la discrimination d’un stimulus en mouvement, et par conséquent le déclenchement de la poursuite oculaire ou d’une saccade vers un objet qui se déplace, sont fortement touchées. Il s’agit donc vraisemblablement dans ce cas d’un déficit d’origine perceptive. Au total, le cortex pariétal contient donc des aires du traitement visuel dont la lésion entraîne des déficits perceptifs, et des aires dont le rôle, représentation spatiale et/ou action, est plus difficile à établir. |
Mouvements des yeux et attention Attention et mouvements des yeux sont étroitement liés. En effet, lors de l’exploration d’une scène visuelle, les objets qui attirent l’attention d’un individu correspondent aux endroits où se pose son regard. Une saccade oculaire est à la fois un mouvement des yeux et un déplacement de l’attention du sujet. Par une étude combinant une tâche de saccade et une tâche de discrimination visuelle, H. Deubel et al. [
19] ont montré que l’attention d’un individu se déplace de manière « obligatoire » au point d’arrivée d’une saccade, empêchant l’identification correcte d’une lettre située à un endroit différent. Mais l’attention peut également se manifester sans déplacement du regard : il est possible de fixer un point de l’espace comme un feu rouge tout en visualisant les déplacements des piétons dans l’environnement. Il s’agit alors d’attention périphérique. L’aire latérale intrapariétale pourrait avoir la fonction d’analyser la scène visuelle pour déterminer quels en sont les objets importants et permettre de sélectionner et de s’orienter vers ces objets par le biais du regard, voire d’autres effecteurs comme la main. Un objet peut attirer l’attention de deux manières : (1) si un éclair apparaît soudainement dans le ciel, nous allons orienter notre regard vers cet éclair. Il s’agit d’attention exogène, dictée par les caractéristiques propres de l’objet (apparition soudaine, couleur vive…) ; (2) lorsque nous avons besoin de nos clés, nous allons activement diriger notre attention sur ces clés pour les localiser et les saisir. Il s’agit d’attention endogène, dictée par nos besoins et par la signification comportementale d’un objet. J.P. Gottlieb et al. [
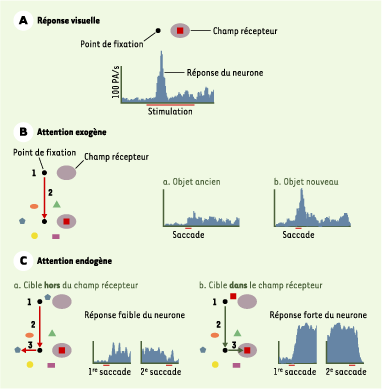
20] ont montré que les neurones de l’aire latérale intrapariétale répondaient à chacune de ces conditions attentionnelles (Figure 2).  | Figure 2.
Réponse des neurones de l’aire latérale intrapariétale dans différentes conditions attentionnelles. A. Définition du champ récepteur. Les neurones des aires visuelles sont caractérisés par leur réponse à un objet visuel placé dans leur champ récepteur (zone de l’espace dans laquelle l’apparition d’un objet provoque une réponse de la cellule). En faisant successivement apparaître un objet en des points différents de l’espace, une cartographie de ce champ récepteur (emplacement et étendue) peut être réalisée. Les neurones de l’aire latérale intrapariétale répondent fortement à l’apparition d’un objet dans leur champ récepteur. PA : potentiels d’action. B. Réponse des neurones de l’aire latérale intrapariétale lors de l’attention exogène. Les neurones de l’aire latérale intrapariétale répondent également lors de tâches attentionnelles. Dans le cas de l’apparition brutale d’un objet dans le champ récepteur, il est donc difficile de distinguer la part de réponse visuelle de la part de réponse attentionnelle exogène du neurone. J.P. Gottlieb et al. [ 20] ont imaginé une astuce pour pouvoir étudier la réponse des neurones de l’aire latérale intrapariétale aux composantes purement attentionnelles de la tâche : ils ne font pas apparaître directement un objet dans le champ récepteur, mais ailleurs dans la scène visuelle. Le singe doit alors réaliser une saccade. Celle-ci modifie la position spatiale du champ récepteur et fait entrer l’objet dans celui-ci. La tâche du singe est la suivante : il doit fixer un point sur un écran, à l’extérieur d’un ensemble d’objets (1) ; le point de fixation s’éteint et réapparaît au centre des objets (2) ; le singe fait donc une saccade vers le point de fixation et fait ainsi entrer un des objets (carré rouge) dans le champ récepteur du neurone (en grisé). Deux variantes sont testées. Dans le premier cas, l’objet qui entre dans le champ récepteur est présent depuis 10 minutes dans la scène visuelle, il est donc ancien et n’attire pas l’attention de manière exogène ; le neurone répond alors à l’entrée de l’objet dans son champ récepteur, mais de façon assez faible (a). Dans le deuxième cas, l’objet qui entre dans le champ récepteur apparaît 500 à 2000 ms avant la saccade du singe ; la nouveauté de cet objet dans la scène visuelle lui confère un poids attentionnel fort : le neurone répond alors de manière bien plus élevée (b). C. Réponse d’un neurone de l’aire latérale intrapariétale pour différentes conditions d’attention endogène. La tâche se décompose en une suite bien précise d’événements. Au début de la séquence, le singe fixe un point localisé à l’extérieur du groupe d’objets (1). Pendant qu’il fixe, un indice (pentagone bleu) apparaît à côté du point de fixation, indiquant à l’animal quelle sera la cible finale de l’essai en cours. Puis le point de fixation s’éteint et réapparaît au centre des objets ; le singe réalise alors une saccade vers le point de fixation et fait donc entrer un des objets dans le champ récepteur du neurone (en grisé) (2). Quand le point de fixation s’éteint définitivement, le singe doit réaliser une saccade vers l’objet qui lui a été présenté en indice (3). Deux variantes sont testées : l’indice, cible de la saccade finale, n’est pas l’objet qui entre dans le champ récepteur et le neurone répond faiblement (a), ou bien l’indice est l’objet qui entre dans le champ récepteur et le neurone décharge fortement depuis l’entrée de la cible dans le champ récepteur jusqu’à la réalisation de la saccade vers cette cible (b). La différence entre ces deux conditions tient à la signification comportementale de l’objet présent dans le champ récepteur du neurone considéré. Ainsi, les neurones de l’aire latérale intrapariétale répondent fortement pour des objets saillants, que ce soit les caractéristiques physiques ou la signification comportementale de ces objets qui déterminent leur pouvoir attentionnel. |
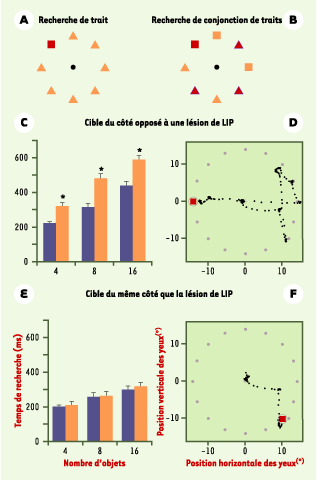
Le rôle de l’aire latérale intrapariétale dans ces mécanismes attentionnels a été mis en évidence par l’étude des performances du singe lors de l’exécution de tâches requérant de l’attention visuelle : des tâches d’extinction et des tâches de recherche visuelle1,
(Figure 3). Dans le cas d’inactivation réversible de l’aire latérale intrapariétale, malgré des mouvements oculaires normaux, le singe a du mal à orienter son attention du côté de l’espace opposé à l’inactivation [12]. Ces déficits sont semblables à ceux observés chez l’homme après lésion, vasculaire par exemple, du lobe pariétal droit (syndrome de négligence).  | Figure 3.
Recherche visuelle et inactivation de l’aire latérale intrapariétale. Une tâche de recherche visuelle est caractérisée par la recherche d’une cible dans un ensemble de distracteurs. Le sujet doit généralement indiquer si la cible est présente ou absente, ou localiser la cible grâce à des mouvements des yeux. Les études de psychophysique ont montré que le comportement de recherche est affecté par la définition de la cible par rapport aux distracteurs. Deux cas de recherche se présentent. Si la cible diffère des distracteurs par une de ses caractéristiques (forme, couleur, orientation…), le temps de recherche du sujet n’est pas affecté par le nombre de distracteurs présents. C’est la condition de recherche de trait (A). En revanche, si la cible est définie comme la combinaison de deux caractéristiques et que les distracteurs partagent les combinaisons restantes (par exemple la cible est un carré rouge parmi des carrés oranges et des triangles rouges et oranges), alors le temps de recherche croît linéairement avec le nombre de distracteurs. C’est la condition de recherche de conjonction de traits (B). Dans le premier cas, on pense que la recherche est parallèle (tous les objets visuels sont traités en même temps) et ne nécessite pas d’attention sélective, alors que dans le deuxième cas la recherche est sérielle (les objets sont traités l’un après l’autre) et requiert de l’attention. Un singe, chez lequel une inactivation de l’aire latérale intrapariétale (LIP) (repérée en électrophysiologie) a été réalisée, doit fixer un point central, puis un ensemble de recherche apparaît comportant 4, 8 ou 16 objets. L’un de ces objets est la cible (carré rouge) et le singe doit aller fixer cette cible le plus rapidement possible (après une ou plusieurs saccades) pour être récompensé. Le singe est testé en condition de recherche de trait et en recherche de conjonction de traits. Après inactivation de l’aire latérale intrapariétale (colonnes oranges), les caractéristiques motrices des saccades ne sont pas affectées. En revanche, en comparaison avec la condition témoin (colonnes bleues), des déficits sont observés en recherche visuelle, et ce uniquement en condition de conjonction de traits (celle qui requiert le plus l’attention sélective). Le singe réalise plus de saccades et par conséquent met plus de temps (en millisecondes, moyennes ± ESM) pour trouver la cible si celle-ci est présentée du côté opposé à la lésion (C, E). L’enregistrement des mouvements des yeux d’un singe, après inactivation de l’aire latérale intrapariétale, lors d’essais individuels dans une condition de conjonction à 16 objets, montre que l’animal oriente préférentiellement son regard du côté de la lésion pour chercher la cible (D, F). Ainsi, l’inactivation de l’aire latérale intrapariétale produirait non pas des déficits dans l’exécution des saccades mais plutôt des déficits d’orientation et de sélection des objets pertinents dans l’environnement. |
|
Deux syndromes relient le cortex pariétal et la fonction de regard : la négligence1 et le syndrome de Balint. La négligence est considérée comme un trouble d’attention et de représentation de l’espace relevant du lobe pariétal droit [
21]. Les patients sont incapables de représenter leur espace gauche : par exemple, ils ne mangent que la moitié de leur assiette ou, s’il leur est demandé de citer le nom de villes françaises, ils ne rapportent que les villes situées à l’Est. Les patients, qui n’ont pas de déficits visuels, sont incapables de s’orienter vers la gauche et de répondre à des stimulations venant de cet espace gauche. Ils présentent généralement une forte extinction. Le syndrome de Balint se traduit par une « paralysie » du regard (peu de mouvements des yeux) et une ataxie optique (déficit dans le guidage visuel de la main vers des objets) [
22,
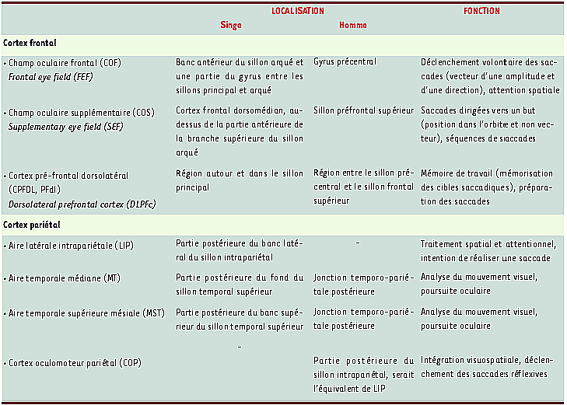
23]. Il est observé après une lésion pariétale bilatérale. Les techniques d’imagerie cérébrale ont démontré que la réalisation de saccades oculaires active un grand réseau pariétal (région du sillon intrapariétal, précuneus et cortex cingulaire) et frontal, assez proche des régions saccadiques identifiées chez le primate (Tableau I) [
24]. Ce réseau saccadique est très proche de celui impliqué dans les mécanismes de poursuite oculaire, avec parfois de légères différences de position et d’extension spatiales entre ces deux tâches oculaires [
25]. Les aires pariétales impliquées dans la poursuite sont principalement le cortex intrapariétal et la jonction avec le sillon temporal supérieur, équivalentes des aires temporale médiane et temporale supérieure mésiale décrites chez le singe.  | Tableau I.
Structures cérébrales centrales impliquées dans le contrôle des mouvements du regard.
|
Plusieurs études se sont intéressées à la comparaison entre la saccade (ou déplacement de l’attention par saccade) et le déplacement de l’attention sans mouvement des yeux [
26,
27]. Un large réseau d’aires corticales, pariétales et frontales, participe aux deux mécanismes, les mouvements des yeux et les déplacements de l’attention utilisant en grande partie le même réseau fonctionnel. Cette observation conforte l’hypothèse prémotrice de l’attention qui propose que, pour déplacer le locus attentionnel, le cerveau utilise le système saccadique comme support, autrement dit que le déplacement de l’attention pourrait correspondre à un déplacement simulé de l’œil. Les deux mécanismes, saccades et déplacements attentionnels, utiliseraient donc le même réseau, mais pas exactement de la même manière. |
Le cortex pariétal est la voie majeure de passage de l’information visuelle nécessaire à la production des mouvements oculaires et donc à l’orientation du regard. Si, pour la poursuite, l’activité du cortex pariétal est une étape du traitement perceptif du stimulus en mouvement, elle servirait, pour les saccades, à la construction d’une représentation spatiale nécessaire au guidage, voire au déclenchement, des mouvements des yeux. Cette fonction inclut la capacité d’anticiper les conséquences sensorielles des mouvements oculaires qui seule peut assurer la mise à jour et la continuité de cette représentation spatiale entre les déplacements successifs du regard [
28]. Enfin, l’aire latérale intrapariétale joue incontestablement un rôle dans la sélection des objets vers lesquels le regard a de grandes chances de s’orienter dans un environnement visuel où notre attention est sollicitée par de multiples stimulus plus ou moins saillants ou pertinents. Il ne faut cependant pas oublier que les traitements effectués au niveau pariétal vont non seulement permettre la production des mouvements oculaires mais également celle des mouvements de la main ou du bras. L’orientation du regard vers un objet est très importante pour pouvoir agir sur cet objet. Elle permet la construction de représentations spatiales tenant compte de l’objet et de l’environnement, mais aussi de son propre corps. Avant de pouvoir saisir un objet, il faut pouvoir calculer sa position dans l’espace par rapport à la main, au bras ou à l’épaule. Le cortex pariétal serait le siège des transformations de coordonnées, à savoir le passage de la représentation d’un objet par rapport à l’œil (position sur la rétine) à sa représentation en coordonnées par rapport aux membres effecteurs [
29,
30].

|
Footnotes |
1. Mays LE, Sparks DL. Dissociation of visual and saccade-related responses in superior colliculus neurons. J Neurophysiol 1980; 43 : 207–32. 2. Schiller PH, Stryker M. Single-unit recording and stimulation in superior colliculus of the alert rhesus monkey. J Neurophysiol 1972; 35 : 915–24. 3. Huerta MF, Krubitzer LA, Kaas JH. Frontal eye field as defined by intracortical microstimulation in squirrel monkeys, owl monkeys, and macaque monkeys. I. Subcortical connections. J Comp Neurol 1986; 253 : 415–39. 4. Bruce CJ, Goldberg ME. Primate frontal eye fields. I. Single neurons discharging before saccades. J Neurophysiol 1985; 53 : 603–35. 5. Schall JD. Neuronal activity related to visually guided saccades in the frontal eye fields of rhesus monkeys : comparison with supplementary eye fields. J Neurophysiol 1991; 66 : 559–79. 6. Funahashi S, Bruce CJ, Goldman-Rakic PS. Mnemonic coding of visual space in the monkey’s dorsolateral prefrontal cortex. J Neurophysiol 1989; 61 : 331–49. 7. Colby CL, Duhamel JR, Goldberg ME. Visual, presaccadic and cognitiva activation of single neurons in monkey lateral intraparietal area. J Neurophysiol 1996; 76 : 2841–52. 8. Ben Hamed S, Duhamel JR, Bremmer F, Graf W. Representation of the visual field in the lateral intraparietal area of macaque monkeys : a quantitative receptive field analysis. Exp Brain Res 2001; 140 : 127–44. 9. Blatt GJ, Andersen RA, Stoner GR. Visual receptive field organization and cortico-cortical connections of the intraparietal area (area LIP) in the macaque. J Comp Neurol 1990; 299 : 421–45. 10. Lynch JC, McLaren JW. Deficit of visual attention and saccadic eye movements after lesions of parietooccipital cortex in monkey. J Neurophysiol 1989; 61 : 74–90. 11. Li CS, Mazzoni P, Andersen RA. Effect of reversible inactivation of macaque lateral intraparietal area on visual and memory saccades. J Neurophysiol 1999; 81 : 1827–38. 12. Wardak C, Olivier E, Duhamel JR. Saccadic target selection deficits after lateral intraparietal area inactivation in monkeys. J Neurosci 2002; 22 : 9877–84. 13. Mazzoni P, Bracewell RM, Barash S, Andersen RA. Motor intention activity in the macaque’s lateral intraparietal area. I. Dissociation of motor plan from sensory memory. J Neurophysiol 1996; 76 : 1439–56. 14. MacAvoy MG, Gottlieb JP, Bruce CJ. Smooth-pursuit eye movement representation in the primate frontal eye field. Cereb Cortex 1991; 1 : 95–102. 15. Tian JR, Lynch JC. Functionally defined smooth and saccadic eye movement subregions in the frontal eye field of Cebus monkeys. J Neurophysiol 1996; 76 : 2740–53. 16. Komatsu H, Wurtz RH. Relation of cortical areas MT and MST to pursuit eye movements. I. Localization and visual properties of neurons. J Neurophysiol 1988; 60 : 580–603. 17. Tusa RJ, Ungerleider LG. Fiber pathways of cortical areas mediating smooth pursuit eye movements in monkeys. Ann Neurol 1988; 23 : 174–83. 18. Dursteler MR, Wurtz RH. Pursuit and optokinetic deficits following chemical lesions of cortical areas MT and MST. J Neurophysiol 1988; 60 : 940–65. 19. Deubel H, Schneider WX. Saccade target selection and object recognition : evidence for a common attentional mechanism. Vision Res 1996; 36 : 1827–37. 20. Gottlieb JP, Kusunoki M, Goldberg ME. The representation of visual salience in monkey parietal cortex. Nature 1998; 391 : 481–4. 21. Bisiach E, Luzzatti C. Unilateral neglect of representational space. Cortex 1978; 14 : 129–33. 22. Hecaen H, de Ajuriaguerra J. Balint’s syndrome (psychic paralysis of visual fixation) and its minor forms. Brain 1954; 77 : 373–400. 23. Vighetto A, Perenin MT. Optic ataxia : analysis of eye and hand responses in pointing at visual targets. Rev Neurol (Paris) 1981; 137 : 357–72. 24. Berman RA, Colby CL, Genovese CR, et al. Cortical networks subserving pursuit and saccadic eye movements in humans : an fMRI study. Hum Brain Mapp 1999; 8 : 209–25. 25. Petit L, Haxby JV. Functional anatomy of pursuit eye movements in humans as revealed by fMRI. J Neurophysiol 1999; 81 : 463–71. 26. Nobre AC, Gitelman DR, Dias EC, Mesulam MM. Covert visual spatial orienting and saccades : overlapping neural systems. NeuroImage 2000; 11 : 210–6. 27. Corbetta M. Frontoparietal cortical networks for directing attention and the eye to visual locations : identical, independent, or overlapping neural systems ? Proc Natl Acad Sci USA 1998; 95 : 831–8. 28. Duhamel JR, Colby CL, Goldberg ME. The updating of the representation of visual space in parietal cortex by intended eye movements. Science 1992; 255 : 90–2. 29. Colby CL, Duhamel JR. Heterogeneity of extrastriate visual areas and multiple parietal areas in the macaque monkey. Neuropsychologia 1991; 6 : 517–37. 30. Snyder LH. Coordinate transformations for eye and arm movements in the brain. Curr Opin Neurobiol 2000; 10 : 747–54. |