| |
| Med Sci (Paris). 2002 December; 18(12): 1197–1199. Published online 2002 December 15. doi: 10.1051/medsci/200218121197.Les deux sous-unités catalytiques de IKK : plutôt cousines que jumelles Gilles Courtois* Unité de Biologie Moléculaire de l’Expression Génique, Département de Biologie Cellulaire et Infection, Institut Pasteur, 25, rue du Docteur Roux, 75724 Paris Cedex 15, France |
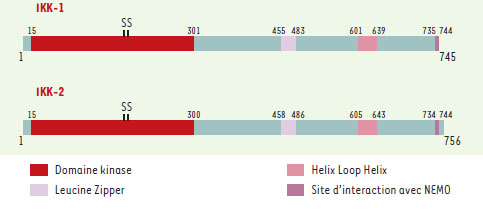
L’identification de IKK (IκB kinase), la kinase qui joue un rôle central dans l’activation du facteur de transcription NF-κB, a représenté une étape décisive dans la caractérisation d’une des voies de signalisation les plus utilisées par les cellules de mammifères. NF-κB, une famille de protéines dimériques formées par combinaison des sous-unités p50, relA, c-rel, p52 et relB, est présent à l’état latent dans le cytoplasme, associé à la molécule inhibitrice IκB. En réponse à une multitude de stimulus, parmi lesquels les cytokines inflammatoires TNF (tumor necrosis factor) et IL-1 (interleukine-1), le lipopolysaccharide (LPS) bactérien, divers mitogènes, des produits viraux, etc., I κB est phosphorylé sur deux résidus sérine spécifiques. Cette modification induit sa destruction par le protéasome et permet à NF-κB de rejoindre le compartiment nucléaire où il contrôle plusieurs centaines de gènes cibles participant à la réponse immune et inflammatoire, à l’adhérence, au cycle cellulaire et à la protection contre l’apoptose [1] Au fil des années, de nombreuses kinases ont été proposées comme jouant un rôle d’IKK mais il a fallu attendre l’identification, sur IκBα, des résidus sérines accepteurs de phosphate (Ser32 et Ser36) pour réellement tester leur spécificité. Utilisant l’approche classique de la purification sur colonnes de chromatographies, les équipes de M. Karin [2] et de F. Mercurio [3] ont finalement réussi à purifier un complexe cytoplasmique de haut poids moléculaire (700-900 κDa) présentant les caractéristiques requises pour être une IKK bona fide : une activité kinase induite par l’IL-1 ou le TNF et la capacité de phosphoryler spécifiquement les Ser 32 et 36 de IκBα. En dépit de son haut poids moléculaire apparent, IKK ne semble constituée que de trois sous-unités : deux sous-unités catalytiques IKK-1 (ou IKKα) et IKK-2 (ou IKKβ) et une sous-unité régulatrice NEMO (ou IKKγ) [4]. IKK-1 et IKK-2 présentent une très forte homologie structurale (51 % d’identité et 67 % d’homologie chez Homo sapiens) et sont constituées toutes les deux d’un domaine catalytique du côté amino-terminal, d’un domaine leucine zipper, qui participe à leur homo- ou hétéro dimérisation, d’un domaine hélice-boucle-hélice, qui coopère avec le domaine catalytique et, à l’extrémité carboxy-terminale, d’un motif peptidique impliqué dans l’interaction avec NEMO (Figure 1). Du fait de cette forte homologie structurale, IKK-1 et IKK-2 ont été considérées pendant très longtemps comme ne jouant qu’un rôle catalytique quelque peu redondant. Une série de publications récentes montre que chacune d’entre elles accomplit, en réalité, une tâche extrêmement spécifique au sein d’IKK… et en dehors.
 | Figure 1. Structure des protéines IKK-1 et IKK-2. Les domaines fonctionnels sont indiqués ainsi que les deux résidus sérine (S) accepteurs de phosphates qui participent à l’activation (Ser176/ Ser180 pour IKK-1 et Ser177/Ser181 pour IKK-2). Dans le cas de IKK-1, Ser176/180 apparaissent être les cibles de la kinase NIK (voir texte). |
|
Acte 1. Une drôle de souris L’invalidation des gènes IKK-1 et IKK-2 chez la souris entraîne deux phénotypes bien distincts. Les souris invalidées pour IKK-2 ne survivent pas au-delà du stade embryonnaire E14,5 en raison d’une apoptose massive au niveau du foie [5–7]. Ce phénotype est également observé avec des souris invalidées pour relA, une des sous-unités de NF-κB, ou des souris mâles invalidées pour NEMO, la sous-unité régulatrice de IKK. De plus, dans les cellules invalidées pour IKK-2, on observe un défaut sévère d’activation de NF-κB en réponse aux cytokines proinflammatoires comme l’IL-1 ou le TNF. Ces résultats confirment donc le rôle essentiel joué par IKK-2 dans la voie NF-κB Les souris invalidées pour IKK-1 présentent un phénotype tout à fait différent [8–10]. Elles survivent jusqu’à la naissance mais souffrent d’une altération majeure au niveau de l’épiderme. Une hyperprolifération incontrôlée des kératinocytes donne aux souris un aspect engoncé et c’est à peine si l’on peut distinguer leurs membres, qui sont en fait parfaitement développés, tant la peau est épaisse. Il est surprenant de constater que NF-κB est normalement activé en réponse aux cytokines pro-inflammatoires. Cela indique donc que, au moins pour ce type de stimulus, IKK-1 ne joue aucun rôle dans la voie de signalisation NF-κB. |
Acte 2. Une vie en dehors de NF-κB ? Plus remarquable encore, le phénotype cutané observé chez les souris invalidées pour IKK-1 n’apparaît pas lié à un défaut d’activation de NF-κB. Utilisant des cultures ex vivo de kératinocytes IKK-1−/−, Hu et al. [11] ont montré que l’hyperprolifération de ces cellules ne s’accompagne pas de leur différenciation. Cela suggère un rôle essentiel de IKK-1 dans la différenciation du kératinocyte mais, de manière inattendue, NF-κB n’est pas impliqué. En effet, la réintroduction de IKK-1 dans les kératinocytes IKK-1−/− restaure leur différenciation alors que l’activation de NF-κB, que l’on obtient en surexprimant IKK-2 par exemple, reste sans effet. La voie de signalisation qui utilise IKK-1 et induit la différenciation des kératinocytes reste obscure mais elle pourrait permettre la synthèse d’un facteur soluble, déjà baptisé kDIF (keratinocyte differentiation-inducing factor), mais dont on ne sait rien à l’heure actuelle. |
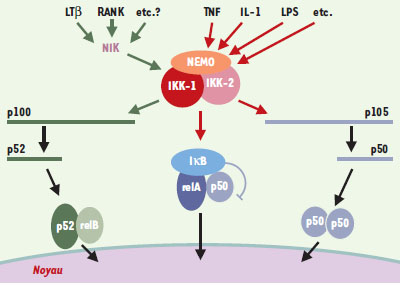
Acte 3. Plus qu’un faire-valoir Au vu de ce qui est décrit ci-dessus, il serait tentant de conclure hâtivement que la sous-unité IKK-1 ne joue qu’un rôle pour le moins accessoire au sein de IKK. Ce n’est, bien évidemment, pas le cas. Des publications récentes démontrent qu’au contraire, cette sous-unité est la cible de voies de signalisation spécifiques et qu’un découplage IKK-1/IKK-2 (voire IKK-1/NEMO) existe, chaque sous-unité pouvant représenter la cible finale de stimulus distincts. L’analyse du rôle de IKK-1 dans le compartiment lymphocytaire, réalisée en greffant des cellules fœtales IKK-1−/− chez des souris irradiées, a en effet révélé une participation de cette sous-unité au processus de maturation et de prolifération des cellules lymphocytaires B [12]. L’action se situe au niveau de la production de p52. p52, tout comme p50, est l’une des deux sous-unités de NF-κB issues de précurseurs (p100 pour p52 et p105 pour p50) et, jusqu’à une date récente, la régulation de leur synthèse restait mal caractérisée. Néanmoins, dans le cas de p100/p52, il avait été montré que la kinase NIK (NF-κB inducing kinase) était impliquée. NIK a débuté sa carrière dans la voie de signalisation NF-κB de manière tonitruante avant de rentrer quelque peu dans le rang. Pendant quelques années, on a situé son intervention en amont de IKK et on l’a impliquée dans toutes les voies de signalisation activant NF-κB. Ce rôle central, proposé sur la base d’expériences de transfection après sur-expression de la molécule sauvage, ou d’une forme dominante négative, n’a malheureusement pas survécu au test de l’analyse in vivo par invalidation génique. En effet, l’activation de NF-κB en réponse à l’IL-1, au TNF ou au LPS n’apparaît pas perturbée dans les cellules NIK−/− [13]. Deux observations essentielles ont néanmoins permis de réintégrer NIK dans la voie de signalisation NF-κB et de préciser le lien qui existe entre IKK-1 et p52. La première montrait que NIK était capable de se lier à la sous-unité IKK-1 et de la phosphoryler au niveau des deux résidus Ser176 et Ser180, sites supposés contrôler son activité catalytique [14]. La seconde que la surexpression de NIK pouvait accroître la production de p52 à partir de son précurseur p100 [15]. Or cet événement n’a plus lieu dans les cellules IKK-1−/−, ce qui suggère fortement que NIK et IKK-1 sont spécifiquement impliquées dans la synthèse de p52. Il restait néanmoins à identifier des stimulus utilisant la voie NIK/IKK-1/p52. Chez les souris NIK−/− et chez les souris aly, mutées dans NIK, l’activation de NF-κB par la lymphotoxine-β est totalement abolie, identifiant un des signaux recherchés [13, 16]. De plus, une élégante étude fondée sur la production de souris transgéniques exprimant une version mutée de IKK-1 (Ser176/180Ala), a identifié chez ces animaux une altération majeure du développement de la glande mammaire [17]. En bref, les souris femelles IKK-1SS/AAne peuvent pas allaiter leur portée à cause d’une prolifération anormale des cellules épithéliales mammaires. Les souris invalidées pour RANK (receptor activator of NF-κB) présentant un défaut similaire, une connexion entre RANK et NIK/IKK-1 a pu être établie. L’ensemble de ces données démontre donc que si IKK-2 joue un rôle essentiel dans de multiples voies d’activation de NF-κB, IKK-1 est nécessaire au bon fonctionnement de voies qui utilisent spécifiquement la kinase NIK et agissent sur la synthèse de p52 à partir de son précurseur p100 (Figure 2).
 | Figure 2. La kinase IKK: un intégrateur des voies de signalisation qui activent NF- κB. Les nouvelles voies de signalisation qui impliquent NIK et IKK-1 et agissent sur la maturation du précurseur p100 sont indiquées par des flèches vertes. On ne sait pas avec certitude si NEMO est impliquée dans ces voies. Les voies « classiques», qui utilisent les sous-unités NEMO et IKK-2, sont indiquées par des flèches rouges. NEMO et IKK-2 ont également été impliquées dans la maturation induite de p105 mais cette induction, à la différence de p100/p52, est généralement limitée, la maturation de p105 étant majoritairement constitutive. |
|
Acte 4. Épiderme (le retour) Si l’étude de IKK-1 a récemment ouvert de nouvelles pistes de recherche, qu’elles concernent ou non la voie NF-κB, l’étude de IKK-2 in vivo risque d’être aussi riche en révélations. Malheureusement, comme nous l’avons mentionné, les souris invalidées pour IKK-2 meurent très tôt au cours de l’embryogenèse, empêchant l’analyse directe du rôle de cette sous-unité chez la souris adulte. La parade est l’invalidation conditionnelle du gène, ce que Pasparakis et al. [18] ont récemment réussi au niveau de l’épiderme. De fait, cette stratégie a permis l’identification d’une nouvelle fonction de NF-κB dans ce tissu. Les souris IKK-2−/− (mutation conditionnelle au niveau de l’épiderme) ne présentent aucun défaut apparent à la naissance mais développent une sévère dermatose 4-5 jours après. Cette dermatose se caractérise par une réaction inflammatoire intense, accompagnée de l’hyperprolifération des kératinocytes. Mais, ces anomalies ne sont pas reproduites ex vivo, et, contrairement aux kératinocytes IKK-1−/−, les kératinocytes IKK-2−/− se comportent normalement ex vivo, sans altération ni de leur prolifération, ni de leur différenciation. Cela indique que les altérations cutanées constatées chez les souris IKK-2−/− (mutants conditionnels) ne résultent pas d’une anomalie intrinsèque aux cellules, mais de l’action des cellules saines environnantes sur les cellules mutées de l’épiderme. Le TNF participe clairement à ce processus puisque le croisement de souris IKK-2−/− (mutants conditionnels) avec des souris invalidées pour le gène codant pour le récepteur du TNF (TNF-R1) prévient l’émergence de ce phénotype. L’analyse de ces souris suggère donc que NF-κB joue bien un rôle dans le tissu cutané, mais plus dans l’homéostasie épidermique, que dans le processus de différenciation des kératinocytes. NF-κB pourrait contrôler le subtil équilibre qui existe entre l’épiderme et le derme au contact du monde extérieur. Le mystère demeure concernant l’événement ou le stimulus qui déclenche la dermatose observée chez les souris IKK-2−/− (mutants conditionnels). Il est essentiel de l’identifier car les patients souffrant d’incontinentia pigmenti, une maladie génétique causée par des mutations du gène NEMO, ainsi que les souris femelles invalidées pour NEMO, développent une dermatose similaire peu après la naissance [19, 20] (→). (→) m/s 2000, n°11, p. 1253 En conclusion, les études récentes confortent l’idée que IKK joue le rôle d’intégrateur des voies de signalisation activant NF-κB. Mais il est remarquable que chaque sous-unité de IKK, notamment les sous-unités catalytiques, semble accomplir une tâche définie et répondre à des stimulus distincts (le rôle de NEMO a été brièvement évoqué ici mais il est essentiel). Et si l’étude de cette fascinante et complexe kinase a de fortes chances de provoquer pour longtemps encore des migraines sévères chez les biologistes moléculaires, les cliniciens/ pharmacologistes peuvent espérer, de leur côté, tirer un grand profit de ce qui en émergera. Il est en effet dorénavant envisageable de cibler un traitement qui bloquerait l’activation de NF-κB par une voie de signalisation donnée en agissant spécifiquement sur IKK-1, IKK-2 ou NEMO, plutôt que de bloquer totalement l’activité de IKK, donc de NF-κB, avec les risques évidents que cela comporte. |
1. Karin M, Ben-Neriah Y. Phosphorylation meets ubiquitination: the control of NF-κB activity. Ann Rev Immunol 2000; 18: 621–63. 2. DiDonato JA, Hayakawa M, Rothwarf DM, Zandi E, Karin M. A cytokine-responsive IκB kinase that activates the transcription factor NF-κB. Nature 1997; 388: 548–54. 3. Mercurio F, Zhu H, Murray BW, et al. IKK-1 and IKK-2 : cytokine-activated IκB kinases essential for NF-κB activation. Science 1997; 278 : 860–6. 4. Israël A. The IKK complex : an integrator of all signals that activate NF-κB ? Trends Cell Biol 2000; 10 : 129–33. 5. Li Q, Van Antwerp D, Mercurio F, Lee KF, Verma IM. Severe liver degeneration in mice lacking the IκB kinase 2 gene. Science 1999; 284: 321–5. 6. Tanaka M, Fuentes ME, Yamaguchi K, et al. Embryonic lethality, liver degeneration, and impaired NF-κB activation in IKK-β-deficient mice. Immunity 1999; 10: 421–9. 7. Li ZW, Chu W, Hu Y, et al. The IKK-β subunit of IκB kinase (IKK) is essential for nuclear factor kappaB activation and prevention of apoptosis.J E xp Med 1999; 189: 1839–45. 8. Hu Y, Baud V, Delhase M, et al. Abnormal morphogenesis but intact IKK activation in mice lacking the IKKα subunit of the IκB kinase. Science 1999; 284: 316–20. 9. Takeda K, Takeuchi O, Tsujimura T, et al. Limb and skin abnormalities in mice lacking IKKα. Science 1999; 284: 313–6. 10. Li Q, Lu Q, Hwang JY, et al. IKK1-deficient mice exhibit abnormal development of skin and skeleton. Genes Dev 1999; 13: 1322–8. 11. Hu Y, Baud V, Oga T, Kim K, Kazuhiko Y, Karin M. IKK controls formation of the epidermis independently of NF-κB via a differentiation inducing factor. Nature 2001; 410: 710–4. 12. Senftleben U, Cao Y, Xiao G, et al. Activation by IKKα of a second, evolutionary conserved, NF-κB signaling pathway. Science 2001; 293: 1495–9. 13. Yin L, Wu L, Wesche H, et al. Defective lymphotoxin-β receptor-induced NF-κB transcriptional activity in NIK-deficient mice. Science 2001; 291: 2162–7. 14. Ling L, Cao Z, Goeddel DV. NF-κB-inducing kinase activates IKK-α by phosphorylation of Ser-176. Proc Natl Acad Sci USA 1998; 95: 3792–7. 15. Xiao G, Harhaj EW, Sun SC. NF-κB-inducing kinase regulates the processing of NF-κB2 p100. Mol Cell 2001; 7: 401–9. 16. Shinkura R, Kitada K, Matsuda F, et al. Alymphoplasia is caused by a point mutation in the mouse gene encoding NF-κB-inducing kinase. Nat Genet 1999; 22: 74–7. 17. Cao Y, Bonizzi G, Seagroves TN, et al. IKKα provides an essential link between RANK signaling and cyclin D1 expression during mammary gland development. Cell 2001; 107: 763–75. 18. Pasparakis M, Courtois G, Hafner M, et al. TNF-mediated inflammatory skin disease in mice with epidermis-specific deletion of IKK2. Nature 2002; 417: 861–6. 19. Smahi A, Courtois G, Vabres P, et al. Genomic rearrangement in NEMO impairs NF-κB activation and is a cause of incontinentia pigmenti. Nature 2000; 405: 466–72. 20. Schmidt-Supprian M, Bloch W, Courtois G, et al. NEMO/IKKγ-deficient mice model incontinentia pigmenti. Mol Cell 2000; 5: 981–92. |