Les protéines sécrétées des familles Hedgehog (Hh) et Wnt/Wingless (Wg) sont des protéines conservées au cours de l’évolution. Elles interviennent dans l’induction et l’organisation de nombreux tissus au cours de l’embryogenèse. Par exemple, chez les vertébrés, elles sont impliquées dans la ventralisation du tube neural et dans le développement des membres. Le dérèglement de leurs voies de signalisation est responsable chez l’homme de nombreuses maladies, comme des syndromes malformatifs au cours de l’embryogenèse précoce ou l’apparition de divers cancers chez l’adulte [1].
Un parallèle peut être fait entre les deux voies de signalisation activées par Hh [2] et Wg [3] (Figure 1). Les molécules Hh et Wg activent respectivement les protéines Smoothened (Smo) et Frizzled (Fz), qui ont une structure semblable aux récepteurs à sept domaines transmembranaires couplés aux protéines G. Cela provoque dans les deux cas l’activation de complexes cytoplasmiques multi-protéiques comprenant des protéines clés pour la régulation de la réponse génique, telles que le régulateur transcriptionnel Armadillo de la famille β-caténine (Arm/β-cat) pour la voie Wg et le facteur de transcription Cubitus interruptus (Ci) pour la voie Hh.
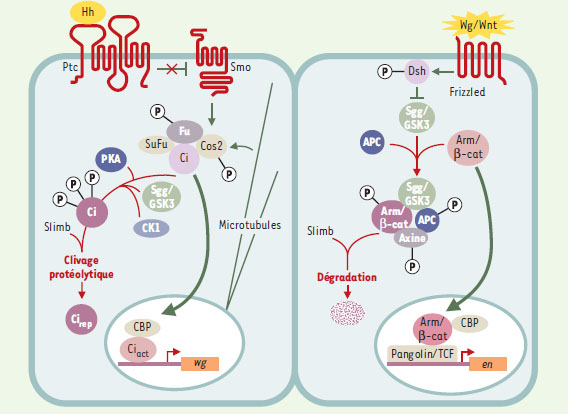
| Figure 1. Voies de signalisation Wg/Wnt et Hh. En vert: voies activées par la liaison des protéines Hh ou Wg. En rouge: régulation de ces voies en l’absence de ces ligands extracellulaires. Voie Hh. La liaison de Hh au récepteur Patched (Ptc) permet d’abolir son activité répressive sur Smo. Cette levée d’inhibition conduit à l’activation par phosphorylation d’un complexe multi-protéique constitué de la kinase Fused (Fu), de la kinésine Costal 2 (Cos2) et du facteur de transcription Ci. La réception du signal Hh provoque également la dissociation de ce complexe des microtubules et la conversion de Ci en Ciact. Ciact se lie à l’ADN et induit en association avec CBP l’expression des gènes cibles de la voie Hh, dont wg. Lorsque les cellules ne reçoivent pas Hh, la voie est inhibée, Ci subissant de multiples phosphorylations d’abord par la PKA puis par Sgg/GSK3 et CK1. Ci est alors clivée en Cirep, molécule réprimant la transcription des cibles géniques de la voie Hh. Voie Wg. La fixation de Wg/Wnt à son récepteur Frizzled (Fz) conduit à l’activation par phosphorylation de Dishevelled (Dsh), qui s’oppose alors à l’activité de la kinase Sgg/GSK3. La protéine Arm/β-cat cytoplasmique est véhiculée dans le noyau où elle s’associe au facteur de transcription Pangolin/Lef1 et au co-activateur CREB binding protein (CBP), pour activer les gènes cibles de Wg, dont le gène engrailed (en). En l’absence de Wg, Sgg/GSK3 phosphoryle les protéines Arm/β-cat, Adenomatous Polyposis Coli (APC) et Axine, associées en un complexe multi-protéique. Arm/β-cat est alors reconnue par la protéine Slimb, ubiquitinylée puis dégradée par le protéasome. |
En l’absence du signal Wg, la protéine Arm est phosphorylée par Shaggy, homologue de la glycogen synthase kinase 3 (Sgg/GSK3). Ainsi phosphorylée, Arm/β- cat est aussitôt dégradée par le processus d’ubiquitinylation/protéasome 26S, grâce à la protéine Slimb, qui l’adresse vers le complexe ubiquitine ligase [4]. L’activation de la voie Wg inhibe l’activité Sgg/GSK3, ce qui favorise l’accumulation de la forme cytoplasmique de Arm/β-cat et conduit à sa translocation nucléaire. Arm/β-cat s’associe alors au facteur de transcription Pangolin/T cell factor (TCF) pour contrôler les gènes cibles de la voie.
Concernant la voie Hh, en l’absence du ligand, Ci est phosphorylée par la protéine kinase dépendante de l’AMPc (PKA), entraînant son clivage en une forme répressive de la transcription (Cirep) [5]. Ce clivage dépend lui aussi de l’activité de Slimb et donc certainement d’un adressage au protéasome. Lorsque la voie est activée, le clivage de Ci est inhibé. La protéine Ci stabilisée est alors activée par un mécanisme encore inconnu [6], conduisant à sa translocation nucléaire et à l’activation maximale des cibles géniques de la voie.
Des travaux récents montrent maintenant que la protéine Sgg/GSK3, initialement impliquée dans la voie Wg comme effecteur négatif, est également un inhibiteur de la voie Hh [7, 8]. L’analyse de la séquence de Ci et la comparaison avec ses homologues de vertébrés, les protéines de la famille Gli, révèlent qu’autour de trois sérines cibles de la phosphorylation par la PKA, il existe une séquence consensus SNRRXSPKAXXSC, où SN serait phosphorylée par Sgg/GSK3 et SC par la caséine kinase 1 (CK1). Des expériences in vitro d’activités kinases associées à la mutagenèse de ces sites possibles de phosphorylation ont confirmé que Ci est bien un substrat de Sgg/GSK3 et de CK1, mais seulement après avoir été précédemment phosphorylée par la PKA. De plus, des expériences réalisées in vivo chez la drosophile montrent qu’en l’absence de fonction de Sgg/GSK3, ou après la mutation des sites SN reconnus par Sgg/GSK3 sur Ci, le clivage de Ci en Cirep est aboli. Il en résulte une accumulation de Ci, suggérant que Sgg/GSK3 participe à sa protéolyse dans des conditions physiologiques. Il reste à déterminer si l’activation par Hh contrôle la stabilité de Ci en réglant l’activité d’une phosphatase, qui s’opposerait à l’action de la PKA, et/ou de Sgg/GSK3 et CK. Alternativement, Hh pourrait déphosphoryler Ci en inhibant directement ces protéine kinases
Finalement, le fait que Sgg/GSK3, déjà impliquée dans la voie Wg et dans la voie insuline [9], soit également un composant de la voie Hh soulève de nombreuses questions. Par exemple, la protéine Sgg/GSK3 serait-elle l’intégrateur de différents signaux extracellulaires, ou bien existeraitil différentes sous-populations de molécules Sgg/GSK3 agissant séparément? Il a été montré in vivo que Ci n’est pas stabilisée par la voie Wg et que Arm/β-cat ne l’est pas par la voie Hh. Par ailleurs, les substrats de Sgg/GSK3 dans la voie Wg (Arm, APC et Axine) (Figure 1) ne nécessitent pas de préphosphorylation par la PKA comme c’est le cas pour Ci. Donc malgré l’implication de Sgg/GSK3 dans plusieurs voies de signalisation, différentes localisations sub-cellulaires associées à de multiples mécanismes de régulation de cette protéine, ainsi que la reconnaissance de sites spécifiques à chacun de ses substrats, permettraient à Sgg/GSK3 de fonctionner indépendamment dans ces trois voies de signalisation.
En conclusion, ces résultats laissent présager un lien fonctionnel entre la GSK3 et les protéines Gli de vertébrés, à l’origine des glioblastomes. À moyen terme, ces données génétiques obtenues chez la drosophile pourraient apporter des informations supplémentaires quant aux mécanismes moléculaires impliqués dans les maladies humaines, mettant en jeu ces voies de signalisation.