Les rythmes journaliers et saisonniers observés dans les processus biologiques, physiologiques et comportementaux sont une donnée fondamentale de tous les êtres vivants, végétaux et animaux, de l’organisme unicellulaire à l’homme. Ces rythmes reflètent la nécessité pour ces processus de se produire de manière optimale à un moment précis du jour ou de l’année. Le cycle veille/sommeil, le cycle d’activité locomotrice (diurne ou nocturne selon les espèces), l’involution et la reprise de l’activité sexuelle au cours de l’année, le cycle d’hibernation, les cycles métaboliques sont des exemples de ces processus physiologiques d’adaptation (predictive homeostasis). Les mécanismes fonctionnels utilisés à cet effet par les êtres vivants sont organisés autour d’horloges biologiques. Ces horloges, génétiquement déterminées, sont le siège de manifestations rythmiques d’une période proche de 24 h (horloges circadiennes) et sont entraînées à 24 h par divers synchroniseurs externes. L’alternance de lumière et d’obscurité au cours du cycle jour/nuit est le plus puissant de ces synchroniseurs (facteur dit photique) mais d’autres facteurs notamment sociaux, comportementaux ou nutritionnels (facteurs dits non photiques) jouent également un rôle important.
Il est maintenant établi que l’intégrité fonctionnelle des organismes dépend de ces mécanismes. Un grand nombre d’individus présente des dysfonctionnements causés par (ou associés à) une déstructuration des rythmes biologiques et ce nombre, du fait des conditions de vie du monde moderne et du vieillissement général de la population, augmente régulièrement. Les individus effectuant des travaux nocturnes ou postés, les voyageurs effectuant des vols transméridiens, certains patients souffrant de dépression saisonnière ou d’autres troubles psychiatriques, certains insomniaques et surtout les personnes âgées sont concernés. À long terme, cette désynchronisation favorise l’installation de troubles cliniques: ulcères, obésité, affections cardiovasculaires, perturbations du sommeil et de la vigilance. Ces dernières années, il est apparu que différentes approches pouvaient être utilisées pour manipuler les rythmes biologiques (lumière, mélatonine, drogues chronobiotiques). L’approche, toutefois, est très empirique et de réels progrès dans le traitement ou la prévention des troubles liés aux rythmes ne pourront être réalisés qu’à partir de connaissances précises sur les mécanismes moléculaires, cellulaires, nerveux et neuroendocriniens impliqués.
Chez les mammifères, l’horloge circadienne principale (celle qui contrôle les grandes fonctions) est localisée dans les noyaux suprachiasmatiques de l’hypothalamus (NSC). Les mécanismes moléculaires permettant d’expliquer la genèse d’une oscillation circadienne sont maintenant partiellement identifiés. À ce jour, huit gènes, appelés « gènes-horloges », ont été identifiés: Per1, Per2, Per3, Clock, BMAL1, Cry1, Cry2 et Caséine kinase ε. Les travaux actuels conduisent à un modèle de rythmicité circadienne fondé sur des rétrocontrôles positifs et négatifs impliquant l’expression rythmique d’ARN codant pour des protéines qui elles-mêmes, en interagissant, règlent la transcription de leurs propres gènes à l’échelle des 24 heures. CLOCK et BMAL1 sont deux régulateurs positifs car ces deux facteurs de transcription forment un hétérodimère qui active la transcription des trois gènes Per et des deux gènes Cry. La protéine PER2 est capable de relancer le cycle circadien en stimulant la transcription du gène BMAL1: une fois que la protéine BMAL1 est synthétisée, elle se dimérise avec CLOCK, dont la synthèse ne varie pas au cours du cycle, pour activer à nouveau la transcription des gènes Per et Cry. Les protéines CRY1 et CRY2 jouent un rôle dans les boucles d’autorégulation circadienne en inhibant l’activation de la transcription des gènes Per et Cry par l’intermédiaire de l’hétérodimère CLOCK-BMAL1. La caséine kinase ε est impliquée dans la phosphorylation des protéines PER cytoplasmiques [1, 2].
Les NSC, toutefois, ne constituent pas une structure homogène. Ils sont composés de plusieurs populations neuronales (neurones à vasopressine -VP-, à vasoactive intestinal peptide -VIP-, à somatostatine, à gastrin releasing peptide -GRP-, etc.) qui possèdent des afférences et des efférences distinctes et ont probablement des fonctions différentes. Les analyses électrophysiologiques montrent que la majorité de ces neurones présentent des propriétés d’horloge et que chacun d’entre eux oscille à son propre rythme [3]. Si les progrès récents ont permis de comprendre comment une cellule de l’horloge est capable d’engendrer un rythme, ils ne permettent pas encore de comprendre comment, de ces éléments dispersés, résulte un signal circadien unique qui est lui-même distribué à l’organisme. Il est probable que cette « unification » soit le résultat de l’organisation fonctionnelle complexe de cette structure. L’étude des mécanismes moléculaires et cellulaires responsables de la synchronisation de l’horloge (ou des horloges au niveau cellulaire), même s’ils sont encore mal compris, renforce cette interprétation. Les premières données sur l’expression des gènes Per1 et Per2 en réponse à des stimulations lumineuses, par exemple, indiquent une régionalisation fonctionnelle dans les noyaux suprachiasmatiques: une zone ventro-latérale (contenant majoritairement des neurones à VIP et à GRP) qui serait directement impliquée dans les mécanismes de la synchronisation et une zone dorsomédiale relativement insensible à la lumière (majorité de neurones à VP) qui serait, elle, impliquée dans l’élaboration du signal circadien.
Deux questions se posent alors: (1) comment, une fois construit (et éventuellement synchronisé à 24 h par le cycle jour/nuit), le signal circadien est il distribué? Et (2) comment celui-ci est-il intégré aux divers niveaux d’organisation de l’organisme?
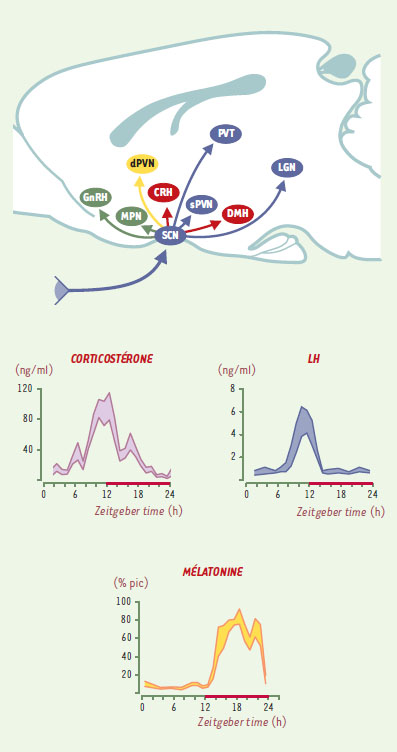
L’hypothèse de départ sous-tendant les travaux de plusieurs équipes est que les NSC transféreraient ce signal circadien aux autres structures du système nerveux par la sécrétion rythmique de divers neurotransmetteurs à partir des terminaisons des voies nerveuses efférentes. Cela pose le problème de l’identification des neurotransmetteurs impliqués et des structures cibles. Les données anatomiques accumulées au cours des dernières années montrent que les neurones des NSC, à l’exception notable des noyaux paraventriculaires du thalamus et des noyaux géniculés latéraux, se projettent presque exclusivement sur des structures hypothalamiques (Figure 1) [4- 6]. Sur la base de ce qui est connu du rôle de ces structures cibles hypothalamiques, il est possible de définir les fonctions qui pourraient être influencées par les NSC à ces différents niveaux [7].
| Figure 1. Structures cérébrales dans lesquelles se projettent les neurones des noyaux suprachiasmatiques de l’hypothalamus (SCN). A. Les SCN peuvent contrôler les rythmes hormonaux: (1) par des projections directes sur certains neurones endocrines, par exemple ceux contenant de la GnRH (gonadotropin-releasing hormone) ou de la CRH (corticotropin releasing hormone); (2) par des contacts indirects avec les neurones endocrines, par l’intermédiaire de neurones présents, par exemple, dans les noyaux pré-optiques médians (MPN), dorso-médians (DMH) ou sub paraventriculaires (sPVN); (3) par une action - via des projections directes sur les neurones autonomes des PVN (aPVN) - sur le système autonome, ce qui permet de préparer les glandes endocrines à recevoir des signaux hormonaux. Le rôle des projections sur les noyaux paraventriculaires du thalamus (PVT) ou sur les noyaux géniculés latéraux (LGN) n’a pas encore été déterminé. B. Exemples de trois rythmes de sécrétion hormonale (d’après [6]). |
Quels sont les neurotransmetteurs impliqués? Les neurones des NSC contiennent des neuropeptides (VIP, VP, GRP et somatostatine). La présence de GABA et de glutamate dans certaines cellules des NSC a aussi été mise en évidence. Un grand nombre des axones des NSC contiennent du GABA et des neuropeptides [6]. La présence de tous ces neurotransmetteurs dote l’horloge d’un grand nombre de combinaisons possibles pour transmettre son signal.
Par exemple, le contrôle de la libération rythmique de la corticostérone par les NSC se fait par au moins deux mécanismes qui impliquent des neurotransmetteurs différents. (1) La libération de VP, le jour, à partir des terminaisons des neurones à VP inhibe la sécrétion de corticostérone en agissant directement - ou indirectement -via les noyaux dorso-médians de l’hypothalamus sur les neurones endocrines des noyaux paraventriculaires de l’hypothalamus (NPV), qui contiennent du CRH et règlent la sécrétion d’ACTH par l’hypophyse [8]. (2) Par une action directe sur les neurones « autonomes » des NPV, les NSC induisent aussi, via le système nerveux autonome, une modification rythmique de la sensibilité du cortex surrénalien à l’ACTH [6].
L’exemple le plus connu de ce rôle du système autonome dans la distribution du message circadien est la sécrétion rythmique de mélatonine. Par une voie polyneuronale impliquant les neurones « autonomes » des NPV, les neurones des NSC se projettent sur des neurones préganglionnaires des noyaux intermédialolatéraux de la corde spinale qui innervent les ganglions cervicaux supérieurs. À partir de ces ganglions, des fibres sympathiques rejoignent la glande pinéale. La libération nocturne de noradrénaline (NA) induit une augmentation rapide de la synthèse de mélatonine. Les projections GABAergiques des NSC sur les NPV sont directement impliquées dans l’effet inhibiteur de la lumière sur la synthèse de mélatonine et l’administration, la nuit, d’agonistes GABAergiques dans les NPV diminue l’activité des fibres sympathiques [9]. La question qui se pose maintenant est de savoir si ces effets du GABA sur la libération de NA et la synthèse de mélatonine sont spécifiques du contrôle du rythme de synthèse de mélatonine par l’horloge ou s’ils relèvent d’un phénomène plus général de contrôle des activités autonomes par l’horloge. En effet, une telle influence de l’horloge sur le système autonome pourrait aussi expliquer l’organisation circadienne de nombreuses fonctions (par exemple, l’homéostasie du glucose, la pression artérielle, etc.) [6]. Même si l’ensemble des neurotransmetteurs impliqués n’est pas encore identifié, ces dernières expériences ont permis de démontrer que le GABA et la VP sont essentiels pour permettre à l’horloge d’entraîner à 24 h les sécrétions hormonales de mélatonine et de corticostérone. En revanche, nos connaissances sur les mécanismes impliqués dans le contrôle des activités comportementales et, en particulier, de l’activité locomotrice circadienne sont encore très limitées. Une transmission humorale ne peut être exclue. En effet, chez des rongeurs dont l’horloge (NSC) a été détruite, la greffe de NSC permet de restaurer un rythme circadien normal d’activité locomotrice. Aucune connexion nerveuse ne semble s’établir entre le greffon et l’hôte, ce qui expliquerait d’ailleurs pourquoi les rythmes de corticostérone et de mélatonine ne sont pas rétablis. Cette observation indique que la diffusion d’un composé à partir du greffon serait suffisante pour induire le rythme d’activité. La nature de ce(s) facteur(s) diffusible(s) comme les structures cibles ne sont pas encore identifiées bien que la zone sub-paraventriculaire de l’hypothalamus, une structure cible importante des NSC, soit un site privilégié pour l’action d’un tel facteur humoral. Le récent travail de Kramer et al. [10] apporte des éléments nouveaux dans ce domaine. En partant de l’hypothèse selon laquelle le rythme d’activité locomotrice était induit par la libération rythmique d’un « facteur locomoteur », ces auteurs ont pensé que l’administration constante de cette substance dans le troisième ventricule devrait bloquer d’une manière réversible l’activité locomotrice. Pour identifier ce facteur locomoteur, ils ont testé la plupart des neuropeptides synthétisés dans les NSC (curieusement pas la VP), les uns déjà connus et les autres nouvellement isolés et identifiés à partir d’ADNc de NSC de hamster. Sur les 32 facteurs peptidiques testés (11 étaient de nouveaux peptides), seul le TGF-α (transforming growth factor α), a bloqué totalement l’activité locomotrice dans la roue et cela sans hypersomnolence ni inhibition générale de l’activité motrice. L’observation la plus spectaculaire est qu’à la fin de l’administration du TGF-α, le rythme repart avec la phase et la période calculée, démontrant ainsi que le fonctionnement de l’horloge n’a pas été affecté par le TGF-α. Le seul récepteur actuellement connu du TGF-α étant le EGFR (epidermal growth factor receptor), les auteurs ont vérifié que le EGF - qui n’est pas présent dans les NSC - bloque l’activité, démontrant ainsi que les récepteurs impliqués étaient bien des EGFR. Les auteurs ont aussi montré que la synthèse de la protéine TGF-α dans les NSC est rythmique avec un pic en début de jour, quand l’activité est faible, et une diminution en début de nuit, quand commence l’activité dans la roue. Cela correspond à ce que l’on attend d’un facteur « inhibiteur de la locomotion ». La démonstration de la présence de récepteurs EGFR dans la zone sub-paraventriculaire de l’hypothalamus permet aussi aux auteurs de conclure que cette zone serait la structure cible des NSC pour le contrôle de l’activité locomotrice circadienne.
En conclusion, ce travail apporte des éléments nouveaux et très originaux qui permettent d’accroître nos connaissances sur les multiples voies et signaux utilisés par les NSC pour distribuer à l’organisme le signal circadien.