On sait depuis maintenant huit ans que trois des quatre récepteurs des facteurs de croissance fibroblastiques (FGFR) jouent un rôle essentiel dans le contrôle de la squelettogenèse, quoique réglant des processus différents [1, 2]. En effet, l’existence de mutations activatrices dans les gènes codant pour le FGFR1 et le FGFR2 entraîne une fusion prématurée des sutures crâniennes (craniosynostose), indiquant donc que les FGF correspondants sont impliqués dans le contrôle de l’ostéogenèse [3]. En revanche, les mutations activant de façon constitutive le FGFR3 entraînent des anomalies de croissance des os longs, inhibant avec plus ou moins de sévérité la différenciation des chondrocytes formant les cartilages de croissance. La production et l’analyse de multiples modèles murins, qu’il s’agisse de souris transgéniques surexprimant les versions sauvages ou mutantes de ces récepteurs, ou encore de souris dépourvues de ces récepteurs, a, depuis, précisé ces observations initiales en déterminant les mécanismes cellulaires sous-jacents à ces régulations. Cependant, aucun FGF particulier n’avait été encore identifié comme étant le ligand de ces récepteurs à l’origine de leur fonction spécifique dans la différenciation des cellules composant le squelette. Il faut dire que la tâche était loin d’être aisée. En effet, à ce jour 22 FGF sont connus, qui, tous, peuvent se lier à chacun des récepteurs, même si les affinités de ces interactions diffèrent [4]. De plus, plusieurs FGF sont exprimés dans des régions où le squelette se forme, notamment dans les bourgeons des membres et les régions cranio-faciales. Enfin, jusqu’à présent, les expériences de surexpression ou d’inactivation in vivo de ces FGF suggéraient que leur intervention était antérieure à la formation des os, et prenait effet notamment lors de la mise en place et de la croissance des bourgeons de membres, plus que lors de la différenciation des cellules du squelette [5]. Le mystère restait donc entier.
Deux études récemment publiées dans Genes and Development éclairent d’une lumière inattendue cette question en proposant qu’un même ligand, FGF18, soit (au moins pour une large part) responsable des fonctions assignées au système FGF/FGFR, que ce soit dans la chondrogenèse ou l’ostéogenèse [6, 7]. On connaissait l’implication de ce facteur dans la squelettogenèse, car son application sur les bourgeons de membre de poulet y perturbait le développement osseux [8]. Les études de Liu et al. [6] et de Ohbayashi et al. [7], utilisant toutes deux le modèle de souris déficientes en FGF18 démontrent maintenant son rôle prépondérant lors de la squelettogenèse et identifient FGF18 comme un probable ligand du FGFR3, responsable de l’action spécifique de ce récepteur au niveau des cartilages de croissance.
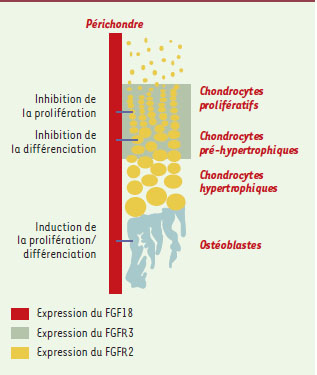
Tout d’abord, l’expression spatio-temporelle de FGF18 comparée à celle des récepteurs FGFR1, 2, et 3 démontre une possible interaction entre ces molécules. Durant la formation des os du crâne, ces quatre gènes sont d’abord co-exprimés dans le mésenchyme ostéogénique, puis FGF18 et FGFR1 sont co-exprimés dans les ostéoblastes alors que l’expression de FGFR2 et de FGFR3 se restreint aux cellules du front ostéogénique [9]. Dans les os longs, FGF18 est exprimé dans le périchondre, comme FGFR2, tandis que FGFR3 est exprimé dans le cartilage de croissance adjacent, plus précisément dans les chondrocytes en phase de prolifération et pré-hypertrophiques (Figure 1) [3]. Cependant, c’est la similitude du phénotype entre des souris déficientes en FGF18 ou en FGFR3 au niveau des cartilages de croissance qui plaide le mieux en faveur d’une interaction spécifique FGF18/FGFR3. En effet, dans ces deux modèles de souris, le cartilage de croissance est élargi, conséquence de l’accroissement du nombre des chondrocytes proliférants et hypertrophiques, dû dans le premier cas à une augmentation de la prolifération cellulaire, et dans le second à une accélération de la vitesse de maturation des chondrocytes hypertrophiques, stade ultime de la différenciation de ces cellules (Figure 1). Il est donc clair que tout comme FGFR3, FGF18 contrôle à la fois la prolifération et la différenciation terminale des chondrocytes. Les anomalies cellulaires des cartilages de croissance s’accompagnent, dans les deux modèles murins, d’une augmentation de l’expression d’Indian Hedgehog (Ihh), de son récepteur patched (Ptc) et du récepteur de PTH/PTHrP (parathyroid hormone related peptide), trois molécules clés appartenant à la même boucle de régulation qui contrôle la vitesse de différenciation hypertrophique des chondrocytes [9]. Compte tenu de ces similitudes cellulaires et moléculaires, FGF18 apparaît comme le ligand préférentiel de FGFR3, récepteur associé au contrôle de la différenciation des chondrocytes pendant la chondrogenèse.
| Figure 1. Expression et rôle du FGF18 dans les cartilages de croissance. FGF18, exprimé dans le périchondre, contrôle négativement la prolifération et la différenciation des chondrocytes en se liant au FGFR3. Il règle par contre positivement la prolifération et/ou la différenciation des ostéoblastes. |
Le second phénotype qu’arborent les souris déficientes en FGF18 concerne non plus la formation des cartilages mais celle des os. Il existe deux processus d’ossification - intramembranaire (os plats du crâne et clavicules), ou endochondrale (os longs et squelette axial) - correspondant respectivement à un mode direct ou indirect de différenciation des ostéoblastes [3, 10]. Les souris FGF18−/− présentent un retard général de l’ossification affectant aussi bien les os longs que les os du crâne, montrant donc que FGF18 serait également impliqué dans les deux types d’ossification. En revanche, deux mécanismes différents sont probablement à l’origine de ces rôles. En effet, dans les régions crâniennes, l’expression de protéines de structure caractéristiques de la différenciation ostéoblastique, l’ostéopontine et l’ostéocalcine, est diminuée tandis que celle de Cbfa1, un facteur de transcription contrôlant la différenciation précoce des ostéoblastes [3], est inchangée. Ce résultat suggère que FGF18 pourrait être nécessaire à la différenciation terminale des ostéoblastes durant l’ossification intramembranaire. Au niveau des os longs, l’expression de l’ostéopontine et de l’ostéocalcine est également diminuée, mais celle de Cbfa1 l’est aussi, suggérant que les os longs des souris mutantes contiennent moins d’ostéoblastes, ou des ostéoblastes très immatures. Durant l’ossification endochondrale, FGF18 interviendrait donc soit à un stade précoce de la différenciation ostéoblastique, soit au niveau de la prolifération des cellules pré-ostéoblastiques (Figure 1). Peut-être cette différence s’explique-t-elle par le type de récepteur auquel FGF18 se lie. Ainsi, il a été précédemment proposé que FGFR1 et FGFR2 remplissent des fonctions distinctes lors de l’ostéogenèse, le premier contrôlant plutôt la différenciation des ostéoblastes, le second la prolifération de leurs cellules progénitrices [11]. L’inactivation des récepteurs FGFR1 et FGFR2 entraînant une létalité embryonnaire précédant la squelettogenèse [12], il est à l’heure actuelle difficile de démontrer cette hypothèse. Pour la même raison, il est impossible de déterminer si le rôle de FGF18 dans ces processus est strictement superposable à la fonction de ces deux récepteurs, ce qui en ferait leur ligand préférentiel au cours de l’ostéogenèse. Des études plus poussées, analysant par exemple des souris chez lesquelles l’expression de FGFR1 ou de FGFR2 est abolie à des stades tardifs du développement, ou spécifiquement dans le squelette (mutants conditionnels), permettront probablement d’éclaircir ces deux points.