Chez les vertébrés adultes, il existe plusieurs types de structures ayant un caractère segmentaire comme les vertèbres et les côtes, les disques intervertébraux, les muscles et les vaisseaux qui leur sont associés, les nerfs et les ganglions spinaux, etc. La segmentation du corps des vertébrés se manifeste très tôt au cours du développement embryonnaire par l’apparition de structures métamériques transitoires, les somites (→). La plupart de nos connaissances sur le développement et la différenciation des somites provient d’études réalisées chez l’embryon d’oiseau. Cependant, les grandes étapes du processus de formation des somites sont équivalentes chez les autres vertébrés, en particulier chez les mammifères.
(→) m/s 1997, n°10, p. 1145
Chez l’embryon de poulet, la première paire de somites apparaît vers 24 heures d’incubation sous la forme de deux sphères constituées de cellules épithéliales, localisées de part et d’autre du tube neural et de la notochorde, en arrière du niveau des futures vésicules otiques (Figure 1). Une fois la première paire de somites formée, la segmentation se poursuit le long de l’axe rostro-caudal de l’embryon au sein de deux bandelettes de tissu mésenchymateux, le mésoderme para-axial non segmenté appelé aussi mésoderme présomitique (MPS). De façon progressive et régulière, un groupe de cellules de la partie la plus rostrale du MPS acquiert une structure épithéliale et une séparation apparaît entre le nouveau somite formé et le MPS mésenchymateux. Néanmoins, la taille du MPS reste relativement constante. En effet, alors que de nouveaux somites se forment dans sa partie rostrale, les cellules du MPS se multiplient et d’autres cellules, issues de la ligne primitive par le processus continu de gastrulation, s’ajoutent à sa partie caudale. Des études expérimentales de ce processus coordonné ont montré, chez l’embryon d’oiseau, que les cellules appartenant au MPS sont en quelque sorte préprogrammées pour constituer un somite à un moment donné du développement et cela indépendamment de la présence des tissus adjacents ou de l’orientation rostro-caudale du MPS dans l’embryon [1]. En effet, on peut inverser l’orientation d’un segment de MPS dans l’embryon sans changer le sens de son processus propre de segmentation.
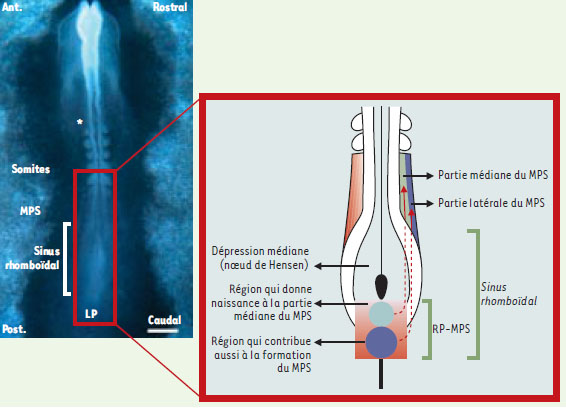
| Figure 1. Embryon de poulet au stade six somites. À gauche. Vue dorsale d’un embryon de poulet de six somites. Le mésenchyme présomitique (MPS) s’étend jusque dans la partie caudale du sinus rhomboïdal où il prend naissance au niveau de la ligne primitive. Àdroite. Schéma représentant un grossissement de la partie caudale de cet embryon. La région du sinus rhomboïdal contient en son centre la dépression médiane où se localise l’organisateur de l’embryon (nœud de Hensen). Caudalement par rapport au nœud de Hensen, s’étendent, dans la ligne primitive, les territoires du futur MPS médian (petit cercle) et du futur MPS latéral (grand cercle). L’ensemble de ces deux territoires constitue la région présomptive des somites. Au cours de la gastrulation, le mouvement de régression du nœud de Hensen et de la ligne primitive s’accompagne de la mise en place des futures cellules somitiques représentées par les deux flèches rouges. La partie pointillée des flèches représente les cellules localisées sous la plaque neurale présomptive. L’expression des gènes de segmentation, c-hairy1, c-hairy2 et lunatic-fringe, dans les cellules de la région présomptive des somites, oscille d’une manière coordonnée dans l’espace et dans le temps de sorte qu’on observe pour chaque gène une vague d’expression dans le sens longitudinal représentant la future disposition médio-latérale du MPS. Ces oscillations « médio-latérales », dans la région postérieure à l’organisateur, sont probablement maintenues jusqu’à l’allongement total de l’embryon. Le fait que la partie médiane du MPS continue à présenter des vagues d’expression des gènes de la segmentation et se segmente en l’absence de sa partie latérale, alors que la partie latérale du MPS montre des profils d’expression très perturbés et une absence de segmentation en l’absence de sa partie médiane, suggère que ces deux régions du MPS ne possèdent pas les mêmes propriétés en ce qui concerne le processus de la segmentation somitique. Les futures cellules médianes recevraient dès leur origine dans la ligne primitive l’information de segmentation alors que les cellules latérales recevraient cette information dans le MPS. Ant.: antérieur. Post.: postérieur. RP : région présomptive. LP : ligne primitive. Barre = 300 mm. Astérisque : localisation de la future vésicule otique. |
Le nombre total de somites et le temps nécessaire à leur formation sont constants et caractéristiques d’une espèce donnée. Chez le poulet, les somites apparaissent à raison d’une paire toutes les 90 minutes en moyenne et, à la fin de la somitogenèse, après 4 jours d’incubation, 52 à 53 paires de somites auront été formées.
Au cours des étapes de la segmentation, on note, chez les embryons d’oiseaux et de mammifères, un gradient rostro-caudal de différenciation du mésoderme para-axial. En effet, alors que les cellules de la ligne primitive sont encore en cours de gastrulation, les cellules du MPS et des somites épithéliaux sont multipotentes et celles des somites les plus antérieurs ont engagé un processus de différenciation dans plusieurs lignages déterminés. Ces différents lignages constituent le sclérotome ventralement et le dermo-myotome dorsalement dans chaque somite. Finalement, les principaux tissus dérivés des somites sont le squelette axial du corps (les vertèbres et les disques intervertébraux ainsi que les côtes et une partie des ceintures scapulaire et pelvienne), le derme dorsal et les cellules musculaires squelettiques à l’exception de celles de la tête (pour revue, voir [2] et [3]).
Si les aspects morphologiques et cellulaires de la somitogenèse ont été largement étudiés, le contrôle moléculaire du phénomène périodique et symétrique qui conduit à la formation des somites chez les vertébrés est demeuré pendant longtemps un des problèmes non résolus de la biologie du développement. Récemment, l’analyse, pendant le processus de formation somitique, de l’expression du gène chicken-hairy1 (c-hairy1), homologue chez le poulet du gène de segmentation hairy de la drosophile, a montré que les cellules du MPS subissent des oscillations d’expression de ce gène d’une durée équivalente au temps de formation d’un somite, c’est-à-dire de 90 minutes [4, 5]. En d’autres termes, toutes les 90 minutes, chaque cellule présomitique alterne une période de temps pendant laquelle des transcrits du gène hairy1 sont détectés, et une autre période caractérisée par l’absence de ces mêmes transcrits. Ces oscillations se répètent jusqu’au moment où cette cellule est incorporée dans un somite épithélial nouvellement formé. Un léger décalage temporel, dans les oscillations d’expression de ce gène entre les différentes cellules présomitiques, entraîne, pour chaque somite qui se forme, l’apparition d’une vague d’expression de c-hairy1 traversant le MPS dans toute sa longueur [4]. Ces oscillations du niveau d’expression de c-hairy1, réitérées toutes les 90 minutes, ont mis en évidence pour la première fois une horloge moléculaire liée à la segmentation somitique.
Plus récemment, deux autres gènes, c-hairy2 et lunatic fringe, présentant également une expression en vague traversant le MPS, ont été identifiés [6–8]. Ces deux gènes sont à présent définis comme étant aussi liés à l’horloge moléculaire de la somitogenèse. Dans d’autres organismes comme la souris [6, 9] ou le poisson zèbre [10], des gènes d’expression cyclique ont également été identifiés dans le MPS.
Afin de mieux comprendre le rôle des gènes d’expression cyclique dans la segmentation des somites, il semblait nécessaire de déterminer si l’expression dynamique et rythmée de ces gènes, c-hairy1, c-hairy2 et lunatic fringe, était déjà établie au niveau des cellules précurseurs du MPS, dans la ligne primitive.
Chez l’embryon de poulet, le nœud de Hensen (extrémité antérieure de la ligne primitive) est considéré comme l’organisateur de l’embryon. Au stade de 5-6 somites, le nœud de Hensen se localise au niveau d’une dépression, au centre du sinus rhomboïdal (Figure 1). Le système de marquage cellulaire, par échanges de fragments d’ébauches embryonnaires équivalentes entre embryons de caille et de poulet, avait montré que certaines cellules du MPS ont pour origine la ligne primitive correspondant à la région postérieure du sinus rhomboïdal [11].
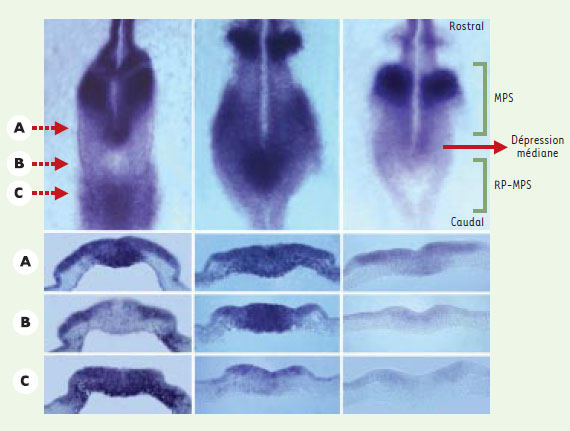
En étudiant attentivement, par hybridation in situ in toto, les profils d’expression des gènes d’expression cyclique au stade de six somites, nous avons noté que chacun de ces gènes présente un profil d’expression évolutif au niveau du sinus rhomboïdal. Cette observation suggère que les futures cellules du MPS subissent des cycles d’expression des gènes c-hairy1, c-hairy2 et lunatic fringe avant même d’être incorporées dans le MPS. La localisation plus précise des cellules subissant des cycles d’expression de ces gènes a été obtenue à partir de coupes histologiques transversales de la région préalablement définie comme la région des somites présomptifs. L’analyse précise des profils d’expression génique montre qu’il existe à la fois une vague d’expression s’étendant selon un axe caudo-rostral dans le MPS, et une vague d’expression progressant le long de la région d’origine des futures cellules somitiques, depuis le bord caudal de la dépression médiane (c’est-à-dire l’extrémité caudale du nœud de Hensen) jusqu’à la région caudale du sinus rhomboïdal (Figure 2).
| Figure 2. Expression dynamique du gène lunatic fringe. En haut. Vues dorsales de la partie caudale de trois embryons de poulet de 6 somites hybridés avec la sonde s’hybridant avec l’ARNm du gène lunatic fringe. On remarque que des embryons ayant le même nombre de somites présentent des profils d’expression très différents. Les mêmes types de profils sont retrouvés aux différents stades de la segmentation. En bas. Des coupes transversales à différents niveaux (A, B, C) du sinus rhomboïdal des embryons représentés ci-dessus montrent qu’il existe, d’une part, une vague d’expression caudo-rostrale au niveau du mésoderme présomitique (MPS) et, d’autre part, une vague distincte au niveau de la région présomptive du MPS (RP-MPS). |
Afin de comprendre ce que représente la zone immédiatement postérieure au nœud de Hensen vis-à-vis des somites, nous avons donc remplacé cette région de l’embryon de poulet par la région équivalente provenant d’un embryon de caille au même stade, selon la technique éprouvée des chimères caille-poulet. Vingtquatre heures après la greffe, des cellules de caille ont été repérées sur des coupes histologiques, à l’aide d’un anticorps spécifique (QCPN), dans la région médiane de la totalité du MPS et de quelques somites nouvellement formés [12]. Ce résultat montre que le territoire présomptif des somites s’étend depuis la limite caudale du nœud de Hensen jusqu’à la partie caudale du sinus rhomboïdal, région dans laquelle on observe les oscillations de plusieurs gènes de segmentation. De plus, la partie rostrale du territoire présomptif des somites donne naissance aux cellules les plus médianes du MPS et des somites. Cela montre que le futur axe médiolatéral du mésoderme para-axial est déjà présent selon l’axe rostro-caudal dans le territoire présomptif des somites, au niveau de la ligne primitive.
Quelle est la signification dans le processus de segmentation de l’existence de deux sous-populations de cellules présomitiques, médiane et latérale, déjà ségrégées au niveau de la ligne primitive ? Ces deux sous-populations cellulaires ont-elles un rôle différent en ce qui concerne ce processus ? Sont-elles engagées et déterminées de la même manière vers la formation des structures segmentées ?
Pour clarifier cette question, nous avons effectué, sur des embryons de poulet aux stades de 15 à 20 paires de somites, des ablations soit de la moitié médiane, soit de la moitié latérale du MPS d’un seul côté de l’embryon [12]. Les embryons opérés ont été cultivés in vitro pendant une durée correspondant à la formation de quatre à six paires de somites (soit six à neuf heures). Après excision du MPS latéral, on observe des somites en nombre égal du côté opéré et du côté témoin. La seule différence réside dans la taille des somites qui se révèlent plus petits du côté de l’ablation. En revanche, après ablation du MPS médian, nous constatons l’absence de structures segmentées du côté où a eu lieu l’ablation, bien que le MPS latéral soit présent comme en atteste l’expression d’un gène caractéristique du mésoderme présomitique, cTbox6L. Ces résultats ont été confirmés in vitro par des cultures d’explants, MPS médian ou MPS latéral. Le MPS latéral, en l’absence du MPS médian, perd l’expression des gènes critiques pour la segmentation (C-Delta1, C-Notch-1, c-hairy1, chairy2 et lunatic fringe) et reste non segmenté, alors que le MPS médian peut effectuer, en l’absence du MPS latéral, une segmentation normale d’un point de vue moléculaire et morphologique [12].
Des expériences antérieures [13] avaient montré que des explants de MPS isolés des tissus adjacents (ectoderme, endoderme, tube neural et lames latérales) n’effectuent pas une segmentation morphologique bien que l’expression du gène C-Delta1 suive un profil d’expression caractéristique fait de bandes qui marquent spécifiquement les segments. Ces résultats, associés à ceux que nous venons de présenter, montrent que le processus morphologique de formation des somites dépend de facteurs d’environnement et qu’il est distinct du processus de segmentation génétique, lequel requiert la présence du MPS médian, mais semble indépendant des autres structures.
En résumé, malgré son aspect homogène, le tissu présomitique est constitué de deux sous-populations cellulaires ayant une origine distincte et qui contiennent des informations différentes quant à la capacité de former des segments. Le MPS médian dérive de la région rostrale de la ligne primitive, en contact direct avec le nœud de Hensen (Figure 1). Afin de former les segments successifs de l’embryon, les cellules issues de cette région s’associent vraisemblablement à des cellules provenant de régions plus caudales de la ligne primitive, correspondant à la région caudale du sinus rhomboïdal. Ces dernières constituent le MPS latéral. Les résultats de nos expériences suggèrent qu’un signal, de nature inconnue, en provenance du MPS médian, est responsable de la mise en place du programme moléculaire qui accompagne la segmentation dans le MPS latéral.
En 1998 [5] étaient décrites des oscillations d’expression de l’ARN messager de c-hairy1 formant une suite de vagues qui balayent le MPS, de façon synchronisée avec la formation des somites. Les conclusions étaient que, pour chaque cellule présomitique, le nombre d’oscillations effectuées serait en rapport direct avec sa localisation rostro-caudale dans le mésoderme paraaxial. Il apparaît maintenant qu’il existe un autre type d’oscillations définissant des vagues qui se déplacent dans le futur axe médio-latéral du territoire présomitique. Les données expérimentales que nous avons obtenues récemment suggèrent que l’horloge moléculaire, qui s’établit très tôt au cours du développement embryonnaire, selon un processus encore inconnu, détermine l’information positionnelle des cellules présomitiques dans les deux dimensions, l’axe médio-latéral et l’axe rostro-caudal.