La persistance du génome de virus humains, sous forme intégrée ou épisomique, est un facteur de risque pour l’émergence de maladies, parmi lesquelles des cancers (lymphomes B et T, lymphomes hodgkiniens et carcinomes) [1]. Un paradigme est le virus d’Epstein-Barr (EBV) qui, après la primo-infection, persiste, chez l’homme, pendant toute la vie des sujets infectés, sous forme circulaire non intégrée, dans le noyau de cellules dont certaines ont été identifiées. Il s’agit des cellules B mémoires circulantes, et des cellules B mémoires des amygdales [2]. Le génome viral nucléaire est compacté en nucléosomes, l’unité structurale de base de la chromatine, formés par l’enroulement d’environ 140 paires de bases d’ADN autour de deux copies de chacune des histones H2A, H2B, H3 et H4. Cette persistance est un facteur de risque pour l’émergence de cancers. Dans la majorité des tumeurs, la chromatine virale est présente dans le noyau de toutes les cellules qui prolifèrent. De plus, la chromatine virale persiste dans le noyau de cellules de certaines de ces tumeurs mises en culture ex vivo, dans des conditions où la pression sélective change totalement. Dans tous les cas, il n’y a pas de cycle productif, et le transcriptome viral est restreint à quelques gènes, dont celui codant pour la protéine EBNA1 [3]. Ces observations suggèrent que la persistance du génome EBV est essentielle à la division des cellules tumorales et soulignent que, chez les humains séropositifs, elle serait un composant important de la carcinogenèse associée à EBV.
La persistance du génome EBV dans les cellules en division implique plusieurs événements non dissociables : la duplication en phase S du génome viral, la ségrégation et l’équi-partition des génomes dupliqués au cours de la mitose, et la persistance nucléaire de ces génomes après la mitose. Une région du génome EBV appelée OriP, et la protéine virale EBNA1, sont essentielles à ces événements (Figure 1A). L’OriP contient deux éléments composés de séquences palindromiques imparfaites répétées : l’un appelé FR (famille de répétitions) est essentiel à la rétention nucléaire et à la persistance du génome viral, l’autre, appelé DS (symétrie en dyade)[4], fonctionne, isolé, comme une origine de réplication [5]. Les séquences palindromiques répétées 20 fois dans la région FR, et quatre fois dans l’élément DS (Figure 1A), sont des sites de fixation pour EBNA1 [6]. Le déclenchement de la réplication du génome viral pendant la phase S du cycle cellulaire serait dû au recrutement, par EBNA1 et sur l’élément DS, de certains composants du complexe d’initiation de la réplication : RPA (replication protein A), ORC2 (origin recognition complex) et le complexe MCM (mini chromosome maintenance) (pour références, voir [7]). Au cours de la phase M du cycle cellulaire, EBNA1 associerait la chromatine virale aux chromosomes mitotiques en se fixant simultanément sur l’élément FR de l’OriP et en se liant à des facteurs cellulaires dont certains ont été caractérisés : sf2/P32, Rch1/importine α, et EBP2 (EBNA1 binding protein 2) (pour références, voir [7]).
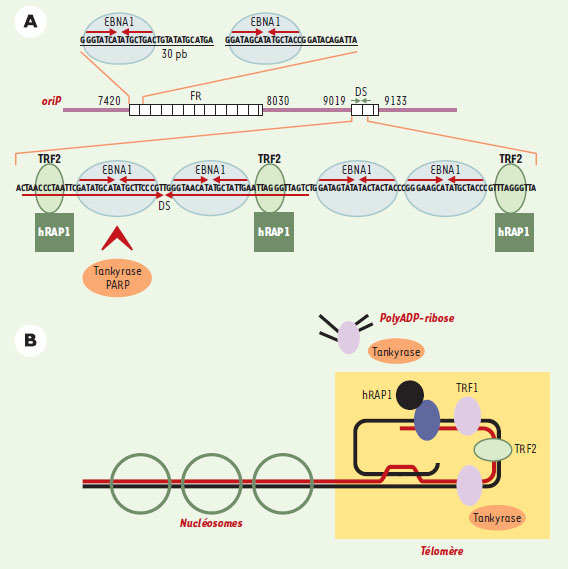
| Figure 1. Association de protéines télomériques avec l’Orip. A. Orip de EBV est formée de deux éléments FR et DS, contenant des séquences palindromiques imparfaites répétées qui fixent le facteur viral EBNA1. L’élément DS contient trois sites de fixation pour la protéine télomérique TRF2, qui recrute le facteur hRAP1. L’élément DS fixe aussi la tankyrase et la PARP, dont un des substrats est EBNA1. B. Les protéines télomériques TRF1 et TRF2 se fixent sous forme dimérique sur des séquences parfaitement répétées TTAGGG formant les télomères des chromosomes humains. TRF1 recrute la tankyrase, une poly (ADP-ribose) polymérase qui a comme substrat TRF1, et qui bloque sa fixation aux séquences TTAGGG. TRF2 recrute les protéines télomériques hRAP1. D’autres facteurs non décrits ici sont aussi associés aux télomères. |
Des travaux du laboratoire de B. Sugden ont démontré qu’un plasmide portant l’OriP peut se répliquer en l’absence d’EBNA1, mais est rapidement perdu au fil des divisions cellulaires [8]. Cibler EBNA1, pour inhiber ses interactions avec ses partenaires cellulaires, est donc une approche thérapeutique pertinente qui pourrait bloquer la réplication et la persistance du génome EBV. Les conséquences potentielles seraient l’arrêt de la prolifération des cellules tumorales et la réduction du risque d’émergence des maladies associées à EBV chez les individus séropositifs et immunodéprimés.
Des travaux récents viennent d’augmenter le nombre de cibles potentielles qui permettraient d’inactiver la réplication et la persistance du génome EBV. Le laboratoire de Paul Lieberman a démontré que l’élément DS contient trois sites TTAGGG qui fixent la protéine télomérique TRF2 (TTAGGG repeat factor 2), uniquement en présence de la protéine EBNA1 (Figure 1A) [7]. D’autres facteurs associés aux répétitions télomériques, hRAP1 et la tankyrase, une protéine à activité ADP-ribose polymérase, sont aussi recrutés sur l’élément DS de manière dépendante d’EBNA1. Enfin, les protéines sf2/P32 et la poly(ADP-ribose) polymérase (PARP) s’associent aussi à l’élément DS, mais l’association élément DS/PARP n’est pas dépendante d’EBNA1 (Figure 1A). L’association à l’élément DS de TRF2 et de la tankyrase a été confirmée, in vivo, dans le génome EBV présent dans les cellules Raji, issues d’un lymphome de Burkitt.
Quelle peut être la fonction des protéines télomériques dans la réplication et le maintien du génome EBV ? La réplication transitoire d’un plasmide portant l’OriP est dépendante d’EBNA1 et est diminuée par des facteurs qui bloquent la fixation de TRF2 aux séquences TTAGGG. Il se pourrait donc que TRF2, en stabilisant la fixation de EBNA1 à l’élément DS, ou en modifiant sa structure chromatinienne, favorise le recrutement sur l’élément DS du complexe d’initiation de la réplication. Cependant, la réplication d’un plasmide ne portant que l’élément DS, qui est une origine de réplication fonctionnelle, est dépendante d’EBNA1, mais n’est pas affectée par l’inactivation des sites de fixation de TRF2. En ce qui concerne le maintien du génome EBV dans des cellules qui se divisent, le nombre de copies d’un plasmide portant l’OriP transfecté dans les cellules B Akata infectées par EBV, augmente en présence d’un inhibiteur de la tankyrase, mais le nombre de copies du génome EBV résident n’est pas affecté. Il semble donc que TRF2 ne soit pas essentiel aux fonctions dépendantes d’OriP dans le génome viral complet.