L’article publié par le groupe de R. Jaenish dans Cell [1] est remarquable à plus d’un titre : c’est le premier essai expérimental grandeur nature de réparation génétique chez la souris à partir de cellules ES (embryonic stem cells) obtenues par transfert de noyaux somatiques. Succès oui, mais partiel en raison de la survenue de problèmes inattendus… Ce qui frappe aussi à la lecture de cet article, c’est que le travail tire parti de toutes les technologies de manipulation du génome développées au cours de ces 10 dernières années, recombinaison homologue dans les cellules ES, excision génétique par le système Cre/lox, transfert nucléaire, et, à ce titre, montre l’ampleur du chemin parcouru et la maîtrise acquise.
Les auteurs ont choisi de « réparer » le déficit immunitaire des souris Rag2−/−. Ces animaux, dont la mutation a été créée par recombinaison homologue, sont dépourvus de la recombinase permettant le réarrangement des gènes d’immunoglobulines formant les récepteurs TCR et BCR. Il en résulte un profond déficit immunitaire. La lignée NK (natural killer), dont la différenciation ne comprend aucune étape de réarrangement génique, est épargnée, ce qui a son importance pour la suite de l’histoire [2].
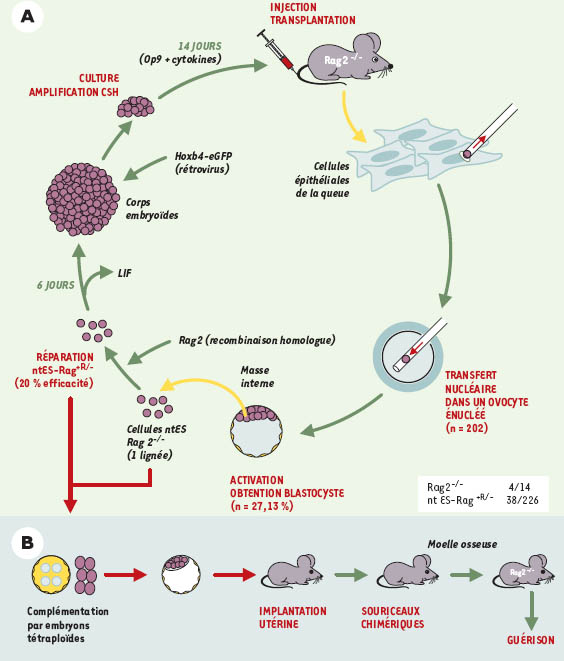
Première étape, obtenir une lignée de cellules ES « autologue » à partir d’une cellule somatique de ces souris par transfert nucléaire [3, 4] (Figure 1). Les noyaux de cellules de souris Rag2−/− mâles ont été transférés dans des ovocytes énucléés bloqués au stade de métaphase II (202 ovocytes injectés), et ces cellules ont progressé jusqu’au stade de blastocystes « artificiellement » (c’est-à-dire en l’absence de fécondation). Sur les 202 ovocytes, 27 se sont développés jusqu’au stade de blastocystes, mais une seule lignée de cellules ES Rag2−/− (que l’on nomme ntES, pour nuclear transfer) a pu être dérivée de la masse interne de ces blastocystes. Avant de « réparer ces cellules ES » encore fallait-il s’assurer de leur « pluripotence », c’est-à-dire de leur capacité à contribuer in vivo à la constitution de tous les tissus embryonnaires. Or, les cellules ES ayant perdu la capacité de donner les annexes (placenta) requises pour le développement d’un embryon viable, elles doivent être « complémentées », ce qui est fait par leur agrégation à des cellules embryonnaires tétraploïdes (obtenues par électrofusion de cellules embryonnaires au stade deux cellules) [5]. Dans ces conditions, tous les tissus des embryons dérivent des cellules ES et les annexes des cellules tétraploïdes. Des 14 embryons tétraploïdes injectés avec des cellules ntES, 4 ont donné des souriceaux viables (Figure 1). Seconde étape, réparer au moins un des allèles Rag mutés dans ces cellules ES. Cela a été réalisé par recombinaison homologue, le gène de sélection (un gène de fusion entre le gène de résistance à l’hygromycine et le gène thymidine kinase) inséré dans la construction remplaçant l’exon 3 de Rag2 et flanqué de la séquence loxP étant excisé secondairement par la recombinase Cre exprimée par transfection transitoire de l’ADNc. À nouveau, la fonctionnalité de ces cellules ES « réparées » (ou ntES-Rag+R/-) a été analysée après leur complémentation avec des embryons tétraploïdes (38 naissances sur 226 embryons tétraploïdes injectés). L’analyse des paramètres hématologiques des souriceaux nés, en particulier du nombre de lymphocytes B et T circulants, du taux d’immunoglobulines, et de la polyclonalité des réarrangements des récepteurs T et B a confirmé la restauration d’un développement lymphoïde T et B normal. Qui plus est, la moelle et le sang néonatal de ces animaux nés de cellules ntES-Rag+R/- étaient capables, après leur transplantation à des animaux Rag2−/− initiaux, de corriger le déficit immunitaire, démontrant bien la fonctionnalité de ces cellules ES « réparées ». Mais, l’obtention de souris à partir de ces cellules ES réparées, sources de tissus à greffer, n’étant évidement possible que dans cette situation expérimentale et pas chez l’homme, il fallait démontrer que ces cellules ES pouvaient se différencier ex vivo en cellules souches hématopoïétiques, seules utilisables comme greffon dans une perspective d’application clinique. Greffées aux souris Rag2−/−, elles corrigeraient alors les conséquences du déficit des cellules souches hématopoïétiques endogènes. Rappelons que l’absence de lignées lymphoïdes B et T endogènes confère un avantage sélectif pour le développement de lignées lymphoïdes à partir d’un greffon normal, et ce même en l’absence de conditionnement (c’est-à-dire de déplétion de l’hématopoïèse endogène, nécessaire pour que la greffe prenne). Ce même avantage sélectif était présent chez les patients atteints de XSCID traités par l’équipe de A. Fisher (→).
| Figure 1.
Représentation schématique des différentes étapes conduisant à la réparation par transfert nucléaire du déficit des souris Rag2−/−.
A. Étape 1 : les cellules isolées de la queue des souris sont cultivées in vitro, puis les noyaux de ces cellules sont transférés dans des ovocytes énucléés. Cette étape conduit à l’obtention de blastocystes, et de leur masse interne une lignée de cellules ES (ntES-Rag2−/−
) est dérivée. Étape 2 : la mutation inactivatrice de Rag2 est corrigée sur un allèle dans ces cellules ntES-Rag2−/−
par recombinaison homologue. Étape 3 : une population de cellules souches hématopoïétiques est obtenue à partir de ces cellules ntES-Rag2+R/-
. Des corps embryonnaires sont tout d’abord obtenus spontanément à partir des cellules ES par le retrait du LIF, puis les cellules des corps embryonnaires sont transduites par l’ADNc HoxB4 par l’intermédiaire d’un rétrovirus murin. L’expression de HoxB4 entraîne la conversion des cellules des corps embryonnaires en une population de cellules souches hématopoïétiques (CSH) que l’on peut amplifier in vitro Étape 4 : la transplantation de ces CSH dérivant des ntES-Rag2+R/-
aux souris Rag2−/−
assure en théorie la réparation du déficit immunitaire, et ne devrait pas poser de problèmes de compatibilité immunologique. En réalité (voir texte), les auteurs se sont heurtés à un rejet de la greffe parles cellules NK des receveurs, les obligeant à utiliser comme receveurs des souris Rag2−/−
croisées avec des souris dépourvues de la chaîne γc, commune aux récepteurs des interleukines 2, 7, 9, 15, et donc indispensable à la prolifération NK. La partie B du dessin schématise la stratégie utilisée pour vérifier la fonction pluripotente des cellules ntES et ntES-Rag2+R/-
. |
(→) m/s 2000, n°5, p. 681
Mais cette démarche se heurtait à deux écueils majeurs : l’un était l’impossibilité jusqu’à maintenant de pouvoir reconstituer le système hématopoïétique de souris irradiées par des cellules ES injectées par voie intraveineuse (voie habituelle de la transplantation de cellules médullaires). Le second provenait de notre incapacité d’identifier, ex vivo, à quel moment les cellules ES s’engagent dans la voie hématopoïétique, et ce en raison de l’absence de marqueurs directs, immunologiques ou autres. C’est là qu’intervient à point nommé le travail de l’équipe de Kyba publié simultanément dans Cell [6], s’inspirant probablement des travaux pionniers du groupe de K. Humphries [7], et identifiant HoxB4 comme l’élément clé de la restriction du potentiel de cellules ES pluripotentes vers les lignées somatiques hématopoïétiques. F. Sainteny nous apprend dans une nouvelle publiée conjointement (→) en quoi ce travail est une découverte majeure.
(→) m/s 2002, n°6-7, p. 649
Il fallait donc ajouter une étape supplémentaire de transduction du gène HoxB4 dans les corps embryoïdes obtenus à partir de ces cellules ntES-Rag2+R/- sevrées de LIF (leukemia inhibiting factor), ce qui entraîne immédiatement leur différenciation et la perte de leur pluripotentialité. Les cellules transduites étaient ensuite cultivées pendant 14 jours en présence de cytokines hématopoïétiques, puis injectées aux receveurs Rag2−/− irradiés. C’est ce qui a été fait, mais, alors qu’on touchait au but, une observation inattendue a grippé le système : l’absence de chimérisme observée après l’administration de cellules « ntES-Rag2+R/- Hox-B4 » aux souris Rag2−/−. Les coupables sont les cellules natural killer (NK) des souris Rag2−/−, présentes en nombre normal et tout à fait fonctionnelles. Les cellules NK repèrent tout intrus qui n’exprime pas les molécules du complexe majeur d’histocompatibilité (CMH), qu’il soit autologue ou allogénique, et l’élimine [8]. A priori, on pouvait espérer, c’était même sa principale justification, que le clonage « thérapeutique » par transfert nucléaire ne modifierait pas le statut immunologique des cellules puisque le donneur et le receveur sont une seule et même personne. Oui, mais… encore faut-il que l’expression des molécules HLA à la surface des cellules ne soit pas modifiée, surtout diminuée, sous l’effet de signaux divers, ce qui risquerait de déclencher l’activation cytotoxique indésirable des cellules NK. C’est exactement la situation à laquelle a été confrontée l’équipe de Jaenish : les cellules ES induites en cellules souches hématopoïétiques par HoxB4 n’exprimaient plus autant de molécules HLA de classe I H2-Kb et H2-Db. Il n’y a pas encore d’explication claire à cette observation, mais on peut remarquer que les cellules embryonnaires du sac vitellin ont, elles aussi, une faible expression des molécules du CMH. Frustrés de ne pouvoir évaluer l’efficacité thérapeutique éventuelle des cellules « ntES-Rag2+R/- HoxB4 », les auteurs ont débarrassé les souris Rag2−/− de leurs cellules NK soit par immunodéplétion en les traitant par l’anticorps anti-NK1.1, ce qui s’est avéré insuffisant, soit en les croisant avec des souris dépourvues de la chaîne γc du récepteur de l’IL-2 (entre autres interleukines)[9]. Chez ces souris Rag2−/− x γc−/− greffées avec des cellules « ntES-Rag2+R/--HoxB4 », on a pu observer effectivement une reconstitution polyclonale, quoique incomplète, des lignées B et T, avec la restauration d’un certain degré de fonctionnalité de la fonction immune, synthèse et sécrétion d’immunoglobulines notamment. L’efficacité était cependant bien inférieure à la reconstitution observée dans les souriceaux nés de la complémentation des embryons tétraploïdes par les cellules ntES-Rag+R/-. Il semble s’agir surtout d’une anomalie de la différenciation terminale, surtout T, et peut-être d’un frein au passage des cellules dans la circulation. Les auteurs privilégient l’hypothèse d’une interférence de l’expression de HoxB4 avec la différenciation lymphoïde, puisque sa surexpression dans d’autres circonstances entraîne une différenciation myéloïde privilégiée. La morale de cette superbe histoire est que la difficulté survient là on ne l’attend pas nécessairement. Cela confirme, s’il en était besoin, que nous avons du pain sur la planche avant que ne paraisse dans Cell le premier article sur l’efficacité thérapeutique du transfert nucléaire chez l’homme. médecine/sciences 2020 ?