| |
| Med Sci (Paris). 2003 May; 19(5): 607–611. Published online 2003 May 15. doi: 10.1051/medsci/2003195607.Impact neurobiologique de la séparation mère/nouveau-né chez le rongeur Valérie Daugé* Inserm U.513, Neurobiologie et psychiatrie, Faculté de Médecine, CHU Henri-Mondor, 8, rue du Général Sarrail, 94010 Créteil, France |
Nécessité de développer des modèles animaux de maladies mentales Le concept de vulnérabilité appliquée à la pathologie mentale implique l’intervention de facteurs génétiques et/ou environnementaux. C’est ainsi que, chez l’animal comme chez l’homme, l’exposition périnatale, c’est-à-dire pré- ou post-natale, à un environnement stressant peut créer une fragilisation à long terme et favoriser l’émergence de troubles du comportement. Chez l’homme, des perturbations relationnelles importantes entre la mère et le nouveau-né (longue séparation non compensée dès les premiers jours de la vie, manque de soins, affect négatif de la mère…) augmentent le risque de survenue de maladies graves telles que des psychoses, des troubles comportementaux ou anxieux, des syndromes dépressifs ou encore des conduites addictives [
1–
5]. C’est l’importance fondamentale, dans toutes les espèces, des liens entre la mère et le nouveau-né dans le développement harmonieux de ce dernier qui sous-tend la pertinence des modèles animaux de séparation mère/nouveau-né qui sont actuellement développés. Cette séparation constitue un stress précoce qui, parce qu’il survient pendant une période de développement neuronal intense, est susceptible d’engendrer un fonctionnement cérébral anormal de façon durable. Ces modèles sont donc étudiés pour tenter de décrire les conséquences neurobiologiques et comportementales néfastes de ce stress précoce sur le développement des petits. |
Des modèles animaux de séparation mère/nouveau-né Il existe plusieurs modèles de séparation mère/nouveau-né chez le rat. Ils diffèrent par le temps de séparation (15 min, 3 h, 6 h, 24 h), ainsi que par l’âge (du 2e au 21e jour de vie) et le sexe des petits au moment de cette séparation. Les modifications induites sont différentes selon le protocole de séparation utilisé [
6]. S. Levine fut le premier, en 1957 [
7], à montrer que des rats nouveau-nés pris et isolés de leur mère quelques minutes par jour étaient plus résistants lorsqu’ils étaient soumis à la répétition d’un stress au cours de leur vie adulte. Une séparation de 15 minutes par jour pendant 14 ou 22 jours entraîne des résultats identiques. Cette séparation entraîne également une protection contre les déficits cognitifs liés à l’âge, une diminution de l’anxiété et une augmentation du rétrocontrôle négatif exercé par les glucocorticoïdes sur l’hippocampe et l’axe hypothalamo-hypophyso-surrénalien (HHPS) du stress [
8,
9] (Figure 1).
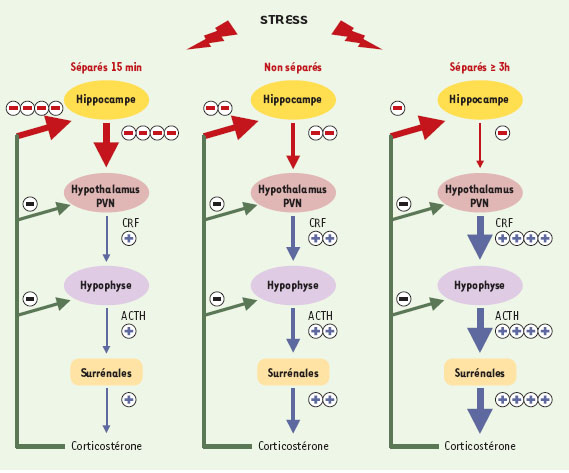
 | Figure 1.
Modifications de l’efficacité du rétrocontrôle négatif exercé par la corticostérone sur l’hippocampe de rats séparés, dès le lendemain de la naissance, 15 min ou 3 h par jour pendant 14 jours. L’axe hypothalamo-hypophysosurrénalien du stress (HHPS) est activé chez tous les animaux lors d’une exposition au stress. Une libération accrue de CRF hypothalamique en résulte tout d’abord, suivie par celle d’ACTH hypophysaire et de corticostérone à partir des glandes surrénales. La corticostérone exerce alors un rétrocontrôle négatif sur l’hippocampe, l’hypothalamus et l’hypophyse, situation observée chez les rats non séparés. L’hippocampe exercerait un effet inhibiteur sur la synthèse de CRF par l’hypothalamus, dont les mécanismes restent à déterminer. Le rétrocontrôle négatif de la corticostérone est augmenté chez les rats séparés pendant 15 min. Les sécrétions diminuées d’ACTH et de corticostérone à la suite d’un stress seraient liées à une augmentation des récepteurs des glucocorticoïdes dans l’hippocampe. Le rétrocontrôle négatif de la corticostérone est diminué chez les rats séparés pendant 3 h au moins. Les réponses accrues en ACTH et en corticostérone après un stress seraient liées à une diminution des récepteurs des glucocorticoïdes dans l’hippocampe et à une augmentation de la quantité d’ARNm du CRF dans l’hypothalamus. ACTH: adrenocorticotropic hormone ; CRF: corticotropin releasing factor ; PVN: noyaux paraventriculaires. |
En revanche, des séparations plus longues, supérieures ou égales à 3 h par jour, augmentent les réponses comportementales face au stress et l’activité de l’axe HHPS en réponse au stress (pour revue, voir [8,
10]). Dans ce cas de séparation plus longue, on observe que le rétrocontrôle négatif exercé par les glucocorticoïdes sur l’axe HHPS est diminué [8,
11,
12] (Figure 1). Des altérations fonctionnelles similaires ayant été décrites dans le cas de la dépression chez l’homme, il a été suggéré que ces modèles de séparation permettraient de modéliser certaines formes de dépression [6, 8]. De nombreuses études ont porté sur l’axe HHPS, dont l’activité est physiologiquement faible pendant les premiers jours de la vie. Il est possible que la suractivation de l’axe HHPS dès la naissance puisse conduire à des effets néfastes à long terme. Une hyposensibilité des systèmes dopaminergiques, impliqués dans les phénomènes de dépendance et dans les états dépressifs, a également été mise en évidence. En effet, une séparation de la mère de 6 h entre le 5e et le 6e jour entraîne une réponse comportementale diminuée aux amphétamines et aux agonistes dopaminergiques, malgré une augmentation apparente de la fonction dopaminergique dans le système mésolimbique, au niveau du noyau accumbens [
13]. Si la plupart des travaux ont été effectués sur des rats mâles adultes, quelques données ont été publiées chez des femelles. Celles-ci semblent moins sensibles que les mâles à certaines modifications induites par une séparation maternelle précoce de 3 h par jour entre les 2e et 21e jours. Elles sont notamment moins sensibles au stress que les rats mâles [
14], semblent moins anxieuses dans un environnement nouveau et manifestent un moindre caractère phobique face à la nourriture [
15]. Elles sont également moins sensibles que les mâles aux effets analgésiques et de tolérance à la morphine [14]. |
Le modèle de séparation 3 h Un modèle de séparation mère/nouveau-né de 3 h par jour, du lendemain de la naissance au 14e jour de vie, a été particulièrement étudié par l’équipe de M.J. Meaney. Il présente l’intérêt d’appliquer des stress répétitifs et de situer la période de stress pendant la croissance cérébrale maximale du nouveau-né (5e au 15e jour de vie). Les animaux devenus adultes montrent une réaction comportementale exacerbée face à différents stress, ainsi qu’une anxiété et une peur accrues face à différents environnements nouveaux. Ils développent une préférence à l’alcool et une augmentation de réponse de l’axe HHPS au stress. Toutes ces modifications étant supprimées par un traitement prolongé par les antidépresseurs, ce modèle a donc été proposé comme un modèle dit de dépression [14,
16,
17]. D’autres systèmes neuronaux sont perturbés. Une diminution de la quantité des récepteurs GABAA et des sites de fixation des benzodiazépines (sites d’action des anxiolytiques), ainsi qu’une augmentation de la libération de noradrénaline face au stress pourraient expliquer l’anxiété accrue des rats soumis à une séparation [16,
18]. Enfin, une diminution de l’expression du transporteur de la dopamine est observée (→), ainsi qu’une hypersensibilité aux effets de différents psychostimulants et au syndrome de sevrage à la morphine (→→) [14,
19]. Cela indique que ce stress précoce perturbe les systèmes dopaminergiques et opioïdergiques, qui ont un rôle important dans les phénomènes de récompense et de dépendance.
(→) m/s 2000, n° 11, p. 1291
(→→) m/s 2000, n° 3, p. 429
|
Séparation de la mère et des congénères : rôle des neuropeptides Plus récemment, une variante du modèle de séparation 3 h a été développée. Le nouveau-né est non seulement séparé de sa mère, mais également de ses congénères pendant 3 h par jour du 1er au 14e jour. Une priorité a été donnée à l’étude des systèmes neuropeptidergiques, en particulier de type enképhalinergique et cholécystokininergique (CCKergique). Les recherches effectuées en neurosciences ces dix dernières années montrent en effet que ces neuropeptides se comportent comme des modulateurs de l’information neuronale et qu’ils sont impliqués dans le développement cérébral et dans certains processus cognitifs. Ces caractéristiques leur confèrent donc un intérêt potentiel original en thérapeutique. Des données de la littérature montrent que le système opioïdergique est, chez le rongeur comme chez le singe, très impliqué dans la mise en place des relations entre la mère et le petit [
20,
21]. Les opioïdes entraînent ainsi des effets renforçateurs positifs (ils favorisent un comportement d’approche ou de consommation) dès le plus jeune âge: l’allaitement induit une libération d’opioïdes chez le nouveauné, ce qui lui permettrait de considérer la tétée comme ayant des propriétés de récompense et favoriserait les associations entre la mère, la tétée et l’état de récompense [
22]. La cholécystokinine (CCK), quant à elle, coordonne la digestion, le métabolisme et la croissance de l’enfant en développement, et semble également participer aux aspects non nutritifs des relations entre l’enfant en développement et sa mère [
23]. Une séparation mère/nouveau- né pourrait conduire chez l’animal à un dysfonctionnement de l’activité des systèmes neuropeptidergiques, avec des perturbations dans la formation d’associations entre les liens maternels et l’état de récompense. Les rats mâles séparés de leur mère pendant l’enfance ne présentent à l’âge adulte aucune modification de l’activité locomotrice, du rythme circadien ou de la mémoire de travail. En revanche, ils se montrent plus anxieux dans certains environnements nouveaux. Cette anxiété accrue est supprimée par le L365,260, un antagoniste sélectif des récepteurs CCK2 ayant des propriétés anxiolytiques. L’eau sucrée étant appétissante pour les rongeurs, la mesure de sa consommation permet d’évaluer l’état hédonique/ anhédonique des animaux. La consommation d’eau sucrée des rats séparés est augmentée, particulièrement lorsque les rats ont subi un stress supplémentaire d’isolement. Cette consommation d’eau sucrée par ces rats retourne à la normale après injection de L365,260. Enfin, une plus grande sensibilité aux effets renforçateurs de la morphine est notée dans un test de préférence de place (un conditionnement de place est favorisé par la morphine) (Figure 2A). Les rats nouveau-nés séparés présentent donc, à l’âge adulte, une hypersensiblité aux effets de récompense (eau sucrée) et aux effets renforçateurs de la morphine, alors que leur réponse nociceptive n’est pas altérée (Figure 2B) : ces données suggèrent l’existence d’un dysfonctionnement cérébral partiel du système opioïdergique.
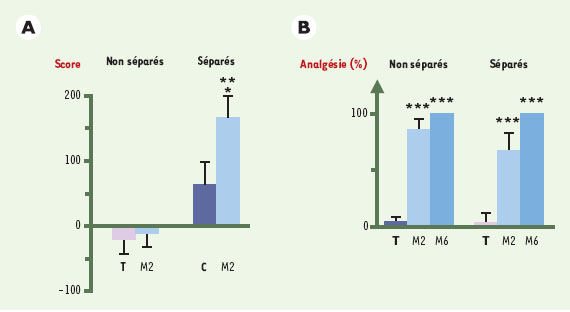
 | Figure 2.
Effets renforçateurs de la morphine chez des rats adultes, séparés ou non de leur mère, dans le test de prèfèrence de place. A. La morphine (M2: 2 mg/kg) est injectée par voie intrapéritonéale à l’animal un jour sur deux pendant 6 jours, dans l’un des deux compartiments de la cage; les autres jours, les rats reçoivent du NaCl (0,9 %) dans l’autre compartiment. Les rats témoins (T) reçoivent du NaCl tous les jours. Le 7 e jour, les rats ne sont pas injectés et ont libre accès aux deux compartiments: le temps passé dans le compartiment où ils ont reçu l’injection de morphine est mesuré. Les résultats sont exprimés en score, égal au temps passé dans le compartiment associé à la morphine - temps passé dans ce même compartiment avant injection de morphine. Seuls les animaux séparés sont conditionnés par une dose de morphine de 2 mg/kg (M2) [ 20]. *p < 0,05 ; **p < 0,01 (M2 séparés versus M2 non séparés). B. Effets anti-nociceptifs de la morphine (M2: 2 mg/kg et M6: 6 mg/kg par voie intrapéritonéale) dans le test du retrait de la queue. Les résultats sont exprimés en pourcentage d’analgésie (latence du retrait de la queue après morphine ou NaCl/latence basale x 100). Les rats adultes répondent de manière similaire aux effets antinociceptifs de la morphine, qu’ils aient ou non été séparés. ***p < 0,001 (M2 ou M6 versus T). |
La plus grande sensibilité des rats séparés aux effets de récompense et aux effets renforçateurs de la morphine pourrait s’expliquer par un hypofonctionnement du système opioïdergique endogène (diminution de synthèse ou de libération des opiacés…) ayant pour conséquence une hypersensibilité des récepteurs opioïdes (augmentation de la quantité des récepteurs et de l’efficacité des voies de transduction des récepteurs), d’où une sensibilité accrue des animaux à la morphine. Plusieurs arguments vont dans ce sens. Tout d’abord, l’administration de RB101, un inhibiteur des deux principales enzymes (aminopeptidase N, endopeptidase neutre) responsables de l’inactivation des enképhalines (qui appartiennent au système opioïdergique), est, contrairement à ce qui se passe chez les rats non séparés, incapable d’augmenter la consommation d’eau sucrée chez les rats séparés. Cette absence d’effet suggère que c’est la libération tonique ou phasique d’enképhalines qui est diminuée chez les rats séparés, puisque le RB101 n’empêche la dégradation des enképhalines que lorsqu’elles sont libérées dans la fente synaptique [
24]. Par ailleurs, une diminution des taux d’ARN messager de la pré-pro-enképhaline est observée dans le noyau accumbens des rats séparés; or, cette structure cérébrale du système mésolimbique est impliquée dans les effets de récompense et dans les effets renforçateurs des opioïdes. Enfin, le niveau de base des enképhalines libérées dans le noyau accumbens est diminué chez les rats séparés par rapport aux animaux non séparés. Ce modèle de séparation mère/nouveau-né met donc non seulement en évidence l’importance des neuropeptides que sont les opioïdes et la CCK dans les relations s’établissant entre mère et nouveau-né, mais également le fait qu’une perturbation de ces relations conduit à un dysfonctionnement des systèmes opioïdergique et cholécystokininergique. Le système opioïdergique endogène mésolimbique serait hypoactif à l’état basal et le système CCKergique serait hyperactivé lors de situations stressantes. |
À travers cet aperçu des données de la littérature, on entrevoit la notion de vulnérabilité à des troubles comportementaux créée par des stress précoces, comme une longue séparation mère/nouveau-né chez l’animal. Ces derniers modèles engendrent des perturbations telles qu’une augmentation de l’anxiété et de la dépendance aux psychostimulants. Les analyses neurobiologiques effectuées chez l’animal adulte montrent que de nombreux systèmes neuronaux (hormones du stress, dopamine, noradrénaline, GABA, peptides) de certaines structures du système limbique sont perturbés [14, 16–19] (voir revue dans [8]). Des études sur l’impact d’un stress précoce sur le développement cérébral devraient permettre de mieux comprendre l’incidence de ce type de stress sur le comportement mental pathologique, sans négliger l’importance de facteurs déclenchants susceptibles de faire basculer l’individu de la vulnérabilité à la pathologie (Figure 3). La mise en place de modèles prenant en compte ces facteurs permettrait d’accéder à une meilleure connaissance des intrications entre vulnérabilité, facteurs déclenchants et pathologie, contribuant ainsi à une meilleure prévention/prédiction des troubles mentaux et, à plus long terme, à une mise en place de stratégies thérapeutiques alternatives.
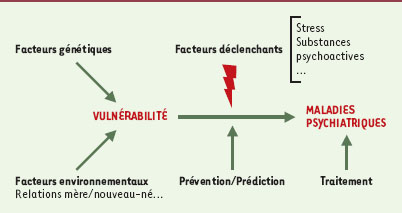
 | Figure 3.
Différents facteurs génétiques et environnementaux sont à l’origine d’une vulnérabilité aux troubles mentaux. Le passage de la vulnérabilité à la pathologie pourrait être engendré par des facteurs déclenchants tels que le stress ou les substances psychoactives. |
|
1. Bifulco A, Harris T, Brown GW. Mourning or early inadequate care ? Reexamining the relationship of maternal loss in childhood with adult depression and anxiety. Dev Psychopathol 1992; 4: 433–49. 2. Canetti L, Bachar E, Galili- Weisstub E, De-Nour AK, Shalev AY. Parental bonding and mental health in adolescence. Adolescence 1997; 32: 381–94. 3. Expertise collective. Facteurs de risque familiaux. Troubles mentaux. Dépistage et prévention chez l’enfant et l’adolescent. Paris: Éditions Inserm, 2002 : 233–49. 4. McEwen BS. Stress, adaptation and disease. Allostasis and allostatic load. Ann NY Acad Sci 1998; 940: 22–44. 5. Spitz RZ. Anaclitic depression: an inquiry into the genesis of psychiatric conditions of early chilhood. Psychoanal Stud Child 1946; 2: 313–7. 6. Hall FS. Social deprivation of neonatal, adolescent, and adult rats has distinct neurochemical and behavioral consequences. Crit Rev Neurobiol 1998; 12: 129–62. 7. Levine S. Infantile experience and resistance to physiological stress. Science 1957; 126: 405. 8. Francis DD, Caldji C, Champagne FN, Plotsky PM, Meaney MJ. The role of corticotropin-releasing factor-norepinephrine systems in mediating the effects of early experience on the development of behavioral and endocrine responses to stress. Biol Psychiatry 1999; 46: 1153–66. 9. Meaney MJ, Aitken DH, van Berkel C, Bhatnagar S, Sapolsky RM. Effect of neonatal handling on agerelated impairments associated with the hippocampus. Science 1988; 239: 766–8. 10. Anisman H, Zaharia MD, Meaney MJ, Meralis Z. Do early-life events permanently alter behavioral and hormonal responses to stressors. Int J Dev Neurosci 1998; 16: 149–64. 11. De Kloet ER, Rots NY, Cools R. Brain-corticosteroid hormone dialogue: slow and persistent. Cell Mol Biol 1996; 16: 345–56. 12. Ladd CO, Owens MJ, Nemeroff CB. Persistent changes in corticotropinreleasing factor neuronal systems induced by maternal deprivation. Endocrinology 1996; 137: 1212–8. 13. Hall FS, Wilkinson LS, Humby T, Robbins TW. Maternal deprivation of neonatal rats produces enduring changes in dopamine function. Synapse 1999; 32: 37–43. 14. Kalinichev M, Easterling KW, Holtzman SG. Early neonatal experience of Long-Evans rats results in long-lasting changes in morphine tolerance and dependence. Psychopharmacology 2001; 157: 305–12. 15. McIntosh J, Anisman H, Merali Z. Short- and longperiods of neonatal maternal separation differentially affect anxiety and feeding in adult rats: gender-dependent effects. Dev Brain Res 1999; 113: 97–6. 16. Caldji C, Francis D, Sharma S, Plotsky PM, Meaney MJ. The effects of early rearing environment on the development of GABAA and central benzodiazepine receptors levels and novelty-induced fearfulness in the rat. Neuropsychopharmacology 2000; 22: 219–29. 17. Huot RL, Thrivikraman KV, Meaney MJ, Plotsky PM. Development of adult ethanol preference and anxiety as a consequence of neonatal maternal separation in Long Evans rats and reversal with antidepressant treatment. Psychopharmacology 2001; 158: 366–73. 18. Liu D, Caldji C, Sharmas S, Plotsky PM, Meaney MJ. Influence of neonatal rearing conditions on stress-induced adrenocorticotropin responses and norepinephrine release in the hypothalamic paraventricular nucleus. J Neuroendocrinol 2000; 12: 5–12. 19. Meaney MJ, Brake W, Gratton A. Environmental regulation of the development of mesolimbic dopamine systems: a neurobiological mechanism for vulnerability to drug abuse. Psychoneuroendocrinology 2002; 27: 127–38. 20. Carden S, Hofer M. Socially mediated reduction of isolation distress in rat pups is blocked by naltrexone but not by RO15-1788. Behav Neurosci 1990; 104: 457–64. 21. Harris JC, Newman JD. Combined opiate/adrenergic receptor blockade enhances squirrel monkey vocalization. Pharmacol Biochem Behav 1988; 31: 223–6. 22. Agmo A, Barreau S, Lemaire V. Social motivation in recently weaned rats is modified by opiates. Dev Neurosci 1997; 19: 505–20. 23. Uvnas-Moberg K. Gastrointestinal hormones in mother and infant. Acta Paediatr Scand 1989; 351: 88–93. 24. Roques BP, Beaumont A, Daugé V, Fournié-Zaluski MC. Peptidase-inactivation of enkephalins: design of inhibitors, biochemical, pharmacological and clinical applications. In: Herz A, ed. Handbook of experimental pharmacology. Part I, opioid. New York: Springer- Verlag, 1993; 104: 545–82. |