L’augmentation de la prévalence de l’obésité, qui conduit à parler de véritable épidémie mondiale, et son association à un risque plus élevé de morbi-mortalité, font de cette affection une véritable priorité de santé publique. L’obésité est associée à de nombreuses maladies dont l’hypertension artérielle, la coronaropathie, les dyslipidémies et le diabète. La fréquence de ces complications augmente lorsque l’excès de tissu graisseux est localisé dans la région abdominale, en particulier autour des viscères [ 1]. Les facteurs responsables de la localisation viscérale de l’excès de graisse ne sont pas parfaitement connus. Cependant, des anomalies de la régulation ou de l’action des glucocorticoïdes (cortisol) pourraient jouer un rôle important. En effet, on sait que les patients souffrant d’un syndrome de Cushing ou recevant un traitement chronique par les glucocorticoïdes présentent une augmentation de la masse grasse viscérale. Ce phénomène est consécutif à l’effet des glucocorticoïdes sur la différenciation des préadipocytes en adipocytes, la lipogenèse induite par la lipoprotéine lipase, et la lipolyse induite par la lipase hormono-sensible (→) (Figure 1).
(→) m/s 2000, n° 6-7, p. 828
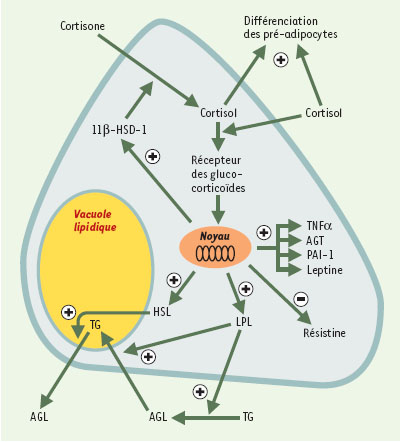
| Figure 1.
Mécanismes d’action de la 11
β
-HSD-1 et des glucocorticoïdes dans le tissu adipeux et leurs conséquences sur le développement de l’obésité viscérale et de ses complications. Représentation schématique d’un adipocyte. Les glucocorticoïdes ont un effet sur la différenciation des pré-adipocytes en adipocytes, la lipogenèse induite par la lipoprotéine lipase (LPL), et la lipolyse induite par la lipase hormono-sensible (HSL). TNFα: tumor necrosis factor α ; AGT: angiotensinogène; PAI-1: inhibiteur de l’activateur du plasminogène-1; TG: triglycérides; AGL: acides gras libres. |
La régulation de la sécrétion et de l’action des glucocorticoïdes est un phénomène complexe et multifactoriel [ 2]. La synthèse et la sécrétion du cortisol par les corticosurrénales sont principalement stimulées par l’adrenocorticotropin hormone (ACTH) hypophysaire, elle-même contrôlée par des neurohormones hypothalamiques. Cet axe est sous la dépendance d’afférences limbiques (hippocampe, amygdale) et du rétrocontrôle négatif des glucocorticoïdes. Dans la circulation sanguine, une large majorité du cortisol est liée à la transcortine. Les glucocorticoïdes agissent sur leurs tissus cibles par l’intermédiaire de récepteurs cytosoliques de deux types: le récepteur des minéralocorticoïdes (qui possède une forte affinité [0,5 nM] pour le cortisol) et le récepteur des glucocorticoïdes (RG) dont l’affinité pour le cortisol est plus faible (5 nM). Il existe deux isoformes du RG: l’isoforme α, active, et l’isoforme β, inactive car incapable de se lier au cortisol. Enfin, l’importance d’un mécanisme supplémentaire de régulation de l’action des glucocorticoïdes, le métabolisme local, intracellulaire, en amont du récepteur, sous la dépendance de la 11β-hydroxystéroïde déshydrogénase (11β-HSD) a été récemment reconnue. La 11β-HSD active ou inactive les glucocorticoïdes circulants et assure ainsi une modulation de leur action, modulation qui présente une spécificité tissulaire.
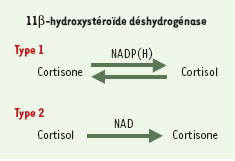
La 11β-HSD appartient à la superfamille des déshydrogénases d’alcool à chaîne courte. Deux isoformes ont été caractérisées (Figure 2). Le gène de l’isoforme de type 1, d’une taille de 30 kb, est localisé sur le chromosome 1 en q32.2, comporte six exons et code pour une protéine de 34 kDa. L’enzyme est présente dans le réticulum endoplasmique et son activité est dépendante de la NADP(H) (nicotinamide adénine dinucléotide phosphate déshydrogénase). La 11β-HSD-1 est bidirectionnelle et exerce une activité de type déshydrogénase (convertissant le cortisol en cortisone, qui est inactive) et de type réductase (convertissant la cortisone en cortisol, voir Figure 2). On admet classiquement qu’in vivo, c’est l’activité réductase qui prédomine; cependant, cette notion a été récemment controversée. La 11β-HSD-1 est présente dans de nombreux tissus de l’organisme (foie, poumon, tissu adipeux, gonades, os, oeil, muscle lisse vasculaire, peau et système nerveux central). Au niveau hépatique, la 11β-HSD-1, en conjonction avec la 5α- réductase, participe au métabolisme des glucocorticoïdes, modulant ainsi les concentrations circulantes de cortisol. Dans les autres tissus cibles, la 11β-HSD-1 va moduler localement l’exposition aux glucocorticoïdes en réglant la conversion locale de cortisone et donc les concentrations intracellulaires de cortisol.
Le gène de l’isoforme de type 2, d’une taille de 6,2 kb, est localisé sur le chromosome 16 en q22, comporte cinq exons et code pour une protéine de 44 kDa. L’enzyme est présente dans le réticulum endoplasmique et dans la zone périnucléaire; son activité est dépendante de la NAD. La 11β-HSD-2 exerce exclusivement une activité de type déshydrogénase. La 11β-HSD-2 est présente dans les tissus cibles de l’aldostérone, c’est-à-dire le rein, le côlon et les glandes sudoripares; son rôle exclusif est de protéger le récepteur des minéralocorticoïdes de l’action du cortisol. Ainsi, la cortisone, produite sous l’action de la 11β- HSD-2 dans le rein, servira de substrat à la 11β-HSD-1 dans d’autres tissus [ 3, 4].
Chez les patients obèses, la sécrétion du cortisol et sa clairance sont augmentées, avec pour conséquence des concentrations circulantes normales, voire diminuées [ 5]. L’augmentation de la sécrétion du cortisol peut être expliquée soit par une stimulation chronique des facteurs centraux de régulation [ 6], soit par une diminution du rétrocontrôle négatif des glucocorticoïdes [ 7]. L’augmentation de la clairance du cortisol est probablement consécutive à une augmentation de l’activité 5α- réductase et à une diminution de l’activité 11β-déshydrogénase dans le foie [ 8].
De plus, de nombreux arguments sont en faveur d’anomalies de régulation de la 11β-HSD-1 dans le tissu adipeux. Chez le rat Zucker, modèle animal d’obésité génétique, l’activité 11β-HSD-1 est augmentée dans le tissu adipeux viscéral [ 9].L’importance d’anomalies de la 11β-HSD-1 dans la physiopathologie de l’obésité a récemment été mise en évidence. Masuzaki et al. [ 10] ont montré que, chez la souris, la surexpression ciblée de la 11β-HSD-1 dans les adipocytes, à un niveau équivalent à celui existant dans le tissu adipeux de l’obèse, reproduit un tableau clinique et biologique comparable à celui de l’obésité viscérale chez l’homme. En effet, ces animaux présentent une augmentation des contenus en cortisol dans le tissu adipeux, et une augmentation de la masse grasse viscérale, qui est particulièrement marquée lors d’un régime riche en lipides. Cette obésité s’accompagne d’une augmentation des concentrations circulantes d’acides gras libres et de leptine, d’une hypertriglycéridémie et d’une diminution de la sensibilité à l’insuline. Ces souris présentent donc une hyperphagie avec résistance à la leptine (→). Elles développent un phénotype très proche de celui des patients présentant un syndrome X (qui associe une résistance à l’insuline, une élévation des triglycérides, une diminution de l’HDL-cholestérol, une obésité et une hypertension artérielle). Dans le tissu adipeux des souris transgéniques, l’augmentation du métabolisme local des glucocorticoïdes entraîne une surexpression de plusieurs facteurs qui jouent un rôle majeur dans les complications de l’obésité: la lipoprotéine lipase, l’angiotensinogène, le tumor necrosis factor α… La surexpression de la 11β-HSD-1 peut donc à elle seule être responsable de l’apparition du phénotype d’obésité.
(→) m/s 1999, n° 11, p. 1276
Chez l’homme, l’exploration de la régulation de la 11β-HSD-1 du tissu adipeux est évidemment plus difficile. Cependant, on a montré que l’activité réductase de la 11β-HSD-1 est augmentée dans le tissu adipeux viscéral par rapport au tissu adipeux sous-cutané du sujet de poids normal et dans le tissu adipeux sous-cutané du patient obèse par rapport au sujet de poids normal [5, 11– 13]. Dans le tissu adipeux sous-cutané du sujet obèse, il existe une corrélation positive entre l’activité de la 11β- HSD-1 et l’indice de masse corporelle [8]. De manière complémentaire, nous avons mis en évidence, par hybridation in situ semi-quantitative, une augmentation des concentrations des ARNm de la 11β-HSD-1 dans le tissu adipeux abdominal de patients obèses, à la fois dans les adipocytes du tissu adipeux sous-cutané et dans les adipocytes et le stroma du tissu adipeux viscéral [ 14] (Figure 3).
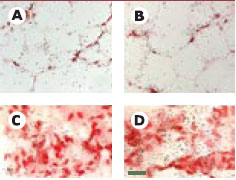
| Figure 3.
Vue en fond clair d’une hybridation in situ des ARNm de la 11
β
-HSD-1 dans le tissu adipeux de sujets de poids normal ou de sujets obèses. Les coupes ont été colorées au rouge neutre et le signal apparaît sous forme de grains d’argent. Les panneaux A et B montrent une vue du compartiment adipocytaire de tissu adipeux sous-cutané provenant d’un sujet de poids normal (A) ou d’un patient obèse (B) . Les panneaux C et D montrent une vue du compartiment stromal sous-cutané (C) ou viscéral (D) de tissu adipeux provenant d’un patient obèse, mettant en évidence une augmentation des concentrations des ARNm de la 11β-HSD-1. La barre de calibration correspond à 50 μm en A et B et 25 μm en C et D (reproduit avec autorisation à partir de [14] - © The Endocrine Society). |
Les variations d’expression de la 11β-HSD-1 dans le tissu adipeux ont des conséquences importantes sur le développement de l’obésité et sur les complications qui l’accompagnent. En effet, il a été récemment montré, dans le tissu adipeux viscéral humain, que l’activité 11β-HSD-1 était principalement de type déshydrogénase dans les pré-adipocytes non différenciés et majoritairement de type réductase dans les adipocytes matures [ 15]. Ces observations suggèrent un effet biphasique des glucocorticoïdes. Sous l’effet de la 11β-HSD-1, une inactivation du cortisol pourrait permettre la prolifération des pré-adipocytes, alors que celle-ci est normalement inhibée par les glucocorticoïdes. L’augmentation de la conversion de cortisone en cortisol pourrait secondairement favoriser leur différenciation en adipocytes [15]. Dans l’adipocyte mature, un hypercorticisme local entraînera une stimulation de l’activité de la lipoprotéine lipase et de la lipase hormonosensible, avec pour conséquence une libération accrue d’acides gras libres dans la circulation porte et l’induction, à l’étage hépatique, d’une résistance à l’insuline et d’une augmentation de la néoglucogenèse. Un excès de cortisol peut aussi entraîner une augmentation de sécrétion de facteurs réglés par cette hormone, impliqués dans les complications thrombotiques de l’obésité tels que l’inhibiteur de l’activateur du plasminogène-1 [ 16].
Les mécanismes responsables de la régulation de l’expression et de l’action de la 11β-HSD-1 sont loin d’être parfaitement connus. Les glucocorticoïdes, les hormones thyroïdiennes, les stéroïdes sexuels, l’hormone de croissance (GH), l’insulin-like growth factor -1, l’insuline, les cytokines et des substances synthétiques tels que les ligands du peroxisome proliferator-activated receptor-γ (PPARγ) règlent l’expression de la 11β-HSD-1 [ 17]. Ainsi la régulation par les glucocorticoïdes ou par la GH de l’expression de la 11β-HSD-1 pourrait moduler le développement et la régulation du tissu adipeux. In vitro, dans un système de culture primaire de cellules stromales de tissu adipeux humain, l’exposition aux glucocorticoïdes est capable d’induire, par une action autocrine, une augmentation de la conversion de cortisone en cortisol [13]. Un phénomène comparable pourrait exister dans les adipocytes et ainsi auto-entretenir un hypercorticisme local et jouer un rôle important dans la physiopathologie de l’obésité. La GH a un effet inhibiteur sur la 11β-HSD-1. En effet, chez des patients insuffisants anté-hypophysaires, le traitement par la GH entraîne une diminution du rapport des métabolites cortisol/cortisone [ 18]. Chez l’obèse, il existe une diminution de la sécrétion de GH, donc une levée de l’effet inhibiteur de la GH sur la 11β-HSD-1. Les effets thérapeutiques des ligands des PPARγ peuvent être, tout au moins en partie, consécutifs à une modulation de l’expression de la 11β-HSD-1. On sait que la rosiglitazone possède un effet inhibiteur sur l’activité de la 11β-HSD-1 et sur l’expression de ses ARNm dans la lignée adipocytaire (3T3-L1) et dans le tissu adipeux viscéral de souris diabétiques db/db [ 19]. De plus, chez l’homme, le traitement par la troglitazone entraîne une diminution de la masse grasse viscérale [ 20]. Ces observations suggèrent qu’une action sur la 11β-HSD-1 pourrait expliquer certains des effets anti-diabétiques des ligands des PPARγ.
En conclusion, les nouvelles données sur le métabolisme local du cortisol dans le tissu adipeux permettent une meilleure compréhension du rôle des glucocorticoïdes dans l’obésité et ses complications et pourraient déboucher sur de nouvelles approches thérapeutiques par le développement d’inhibiteurs spécifiques de la 11β-HSD-1.