| |
| Med Sci (Paris). 2003 April; 19(4): 411–413. Published online 2003 April 15. doi: 10.1051/medsci/2003194411.Le récepteur nucléaire orphelin Rev-erbα oscille entre répression et activation Michèle Teboul* and Franck Delaunay Laboratoire de physiologie des membranes cellulaires, Cnrs UMR 6078, Université de Nice-Sophia Antipolis, Chemin du Lazaret, 06230 Villefranche-sur-Mer, France MeSH keywords: Animaux, Horloges biologiques, Rythme circadien, Protéines de liaison à l'ADN, Régulation de l'expression des gènes, Humains, Membre-1 du groupe D de la sous-famille-1 de récepteurs nucléaires, Récepteurs cytoplasmiques et nucléaires |
La plupart des organismes contrôlent leur physiologie et leur comportement selon un rythme de 24 heures grâce à une horloge biologique interne. Chez les mammifères, cette horloge réside dans les noyaux suprachiasmatiques (NSC) de l’hypothalamus et elle est synchronisée par la lumière via le tractus rétino-hypothalamique (→). En aval, le contrôle rythmique des fonctions physiologiques semble se faire soit directement, soit par l’intermédiaire d’horloges circadiennes présentes au sein même des organes périphériques. Dans ce dernier cas, l’horloge des NSC synchroniserait les rythmes produits localement par les oscillateurs périphériques (→→).
(→) m/s 2000, n° 4, p. 504
(→→) m/s 2001, n° 4, p. 501
Les rythmes circadiens sont contrôlés par des gènes « horloges » dont le mode d’action est maintenant extrêmement bien documenté dans la plupart des organismes modèles [
1]. Cependant, chez les vertébrés, les données récentes issues entre autres des expériences d’invalidation de certains gènes « horloges » indiquent que certaines pièces du puzzle sont encore manquantes. L’une d’elles vient d’être identifiée par l’équipe d’U. Schibler (Genève, Suisse) qui montre que le récepteur nucléaire orphelin Rev-erbα constitue un composant central de l’horloge des mammifères [
2] |
L’oscillateur moléculaire de l’horloge circadienne des mammifères L’élément central de l’horloge circadienne est un oscillateur moléculaire constitué de plusieurs gènes « horloges » qui interagissent entre eux pour former une boucle d’autorégulation négative transcriptionnelle et post-traductionnelle. Les gènes Clock et Bmal1 codent pour deux facteurs bHLH-PAS qui s’hétérodimérisent et activent la transcription des gènes Period (Per1, Per2, Per3) et Cryptochrome (Cry1 et Cry2) via des séquences CACGTG présentes dans les promoteurs de ces gènes. Lorsque les protéines PER et CRY atteignent une concentration critique, les complexes PER:CRY entrent dans le noyau où ils répriment la transcription de leur propre gène en bloquant l’activité de l’hétérodimère CLOCK:BMAL. C’est cette boucle entre activation et répression qui engendre un oscillateur moléculaire dont la période est de 24 heures. La phosphorylation, la dégradation et l’entrée dans le noyau des protéines de l’horloge contrôlent finement ce mécanisme et permettent d’entretenir l’oscillation en l’absence de stimulus externe [
3,
4]. L’expression en antiphase des gènes Clock et Bmal1, d’une part, et des gènes Per et Cry, d’autre part, suggère que ces deux groupes de gènes sont sous le contrôle de mécanismes différents. D’ailleurs, l’analyse des souris mutantes pour les gènes Per2, Cry1 et Cry2 a montré la régulation positive du gène Bmal1 par les répresseurs PER2, CRY1 et CRY2 [
5]. Ce paradoxe apparent s’explique en fait par l’implication du récepteur nucléaire orphelin Rev-erbα, un nouveau venu dans l’oscillateur moléculaire. |
Le récepteur orphelin Rev-erbα : un gène énigmatique Le récepteur Rev-erbα (NR1D1) est un membre de la superfamille des récepteurs nucléaires. Il est considéré comme un récepteur orphelin car il n’a pas de ligand connu et est dépourvu du domaine de transactivation AF2 dépendant du ligand, présent dans la plupart des récepteurs nucléaires. C’est de ce fait un répresseur transcriptionnel constitutif qui se fixe sur des éléments de réponse de type WAWNTRGGTCA appelés RORE (ROR [retinoid acid related orphan receptor] response element); ce motif a initialement été trouvé comme séquence cible des récepteurs nucléaires orphelins ROR, qui, eux, sont des activateurs transcriptionnels. Depuis plus de 10 ans, Rev-erbα a été impliqué dans divers processus biologiques sans que l’on parvienne à établir précisément son rôle physiologique. Son expression est par exemple réglée positivement lors de la différenciation adipocytaire et par les fibrates. À l’inverse, la différenciation musculaire et les glucocorticoïdes répriment Rev-erbα. L’invalidation de ce gène chez la souris conduit à des anomalies de développement du cervelet [
6]. Récemment, il a été montré que le transcrit Rev-erbα était exprimé selon un rythme circadien très marqué dans le foie et les NSC de mammifères, ainsi que dans la rétine et la glande pinéale de l’embryon de poisson zèbre [
7–
9] (→). La conservation évolutive de la régulation circadienne de Rev-erbα et la présence de transcrits au sein même de l’horloge centrale offraient une piste prometteuse en faveur d’un rôle de ce récepteur orphelin dans le système circadien des vertébrés.
(→) m/s 2001, n°3, p. 365
|
REV-ERBα : un lien moléculaire entre les répresseurs et les activateurs de l’oscillateur circadien En examinant le promoteur du gène Bmal1, l’équipe d’U. Schibler a identifié deux séquences RORE. En réalisant des expériences de retard sur gel avec des extraits nucléaires de foie et les séquences RORE de Bmal1, ces auteurs ont identifié un complexe dont le maximum d’activité de fixation correspondait à la fois au pic d’expression de Rev-erbα et au minimum d’expression de Bmal1. Ce résultat, ainsi que l’expression rythmique de Rev-erbα dans les NSC, leur a suggéré que Rev-erbα pourrait régler négativement l’expression du gène Bmal1. Afin de tester cette hypothèse, l’équipe d’U. Schibler a invalidé le gène Rev-erbα chez la souris. En analysant l’expression des gènes de l’horloge chez ces souris mutantes, les auteurs ont découvert un niveau d’expression de Bmal1 é levé et constant dans le foie et les NSC. Le même phénotype est observé dans le foie pour les transcrits Clock et Cry1. REV-ERBα est donc, in vivo, un répresseur de la transcription de Bmal1, mais aussi de Clock et Cry1. En revanche, l’expression cyclique de Cry2 et Per2 n’est pas affectée chez les souris mutantes. Lorsqu’elles sont placées dans l’obscurité ou sous une lumière constante, ces souris conservent un rythme activité-repos malgré l’altération prononcée de l’expression cyclique de Bmal1 et Clock. En revanche, elles ont une période plus courte et plus hétérogène, ainsi qu’une réponse exacerbée à un stimulus lumineux par rapport aux souris sauvages. Le phénotype moléculaire et comportemental des souris mutantes montre que Rev-erbα n’est pas indispensable à la production du rythme mais qu’il est un régulateur majeur de la durée de la période et de la réponse au déphasage de l’horloge circadienne. Puisque PER2 agit positivement sur l’expression de Bmal1, il pourrait réprimer l’expression du répresseur Rev-erbα et ainsi activer de façon indirecte la transcription de Bmal1. L’analyse de l’expression de Rev-erbα chez les souris dont les gènes Per2 ou Per1 et Per2 ont été invalidés montre effectivement que Rev-erbα a un pic d’expression considérablement avancé chez les souris déficientes en Per2, et que son expression est élevée et constitutive chez les double-mutants Per1 /Per2. Les protéines PER sont donc des régulateurs négatifs de l’expression de Rev-erb α.
L’ensemble de ces résultats placent désormais le récepteur nucléaire orphelin Rev-erbα au centre de l’oscillateur circadien des mammifères dans lequel il constitue un lien moléculaire entre les facteurs répresseurs et activateurs (Figure 1). Récemment, le récepteur orphelin RORβ, le récepteur des glucocorticoïdes et les récepteurs de l’acide rétinoïque ont également été impliqués dans le contrôle de l’horloge [
10–
12]. De plus, des cribles d’expression réalisés avec des puces à ADN ont identifié plusieurs autres récepteurs présentant une expression rythmique [
13–
15]. Les récepteurs nucléaires apparaissent donc de plus en plus comme des régulateurs majeurs du système circadien.
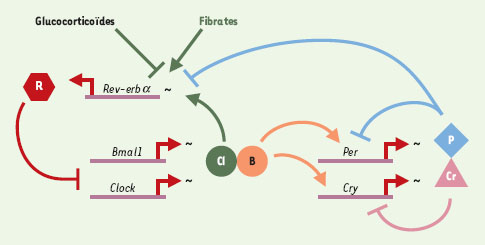
 | Figure 1.
Rev-erb α est un lien moléculaire entre les répresseurs et les activateurs de l’oscillateur circadien. Les gènes Bmal1 et Clock sont des activateurs des gènes Per et Cry. Ces derniers subissent un autocontrôle négatif et répriment également le gène Rev-erbα. La protéine REV-ERB α (hexagone rouge) réprime à son tour l’expression de Bmal1 et de Clock. Ce mécanisme rend compte du déphasage des pics d’expression des activateurs CLOCK et BMAL1 et des répresseurs PER et CRY. Rev-erb α est aussi sous le contrôle des glucocorticoïdes et des fibrates. Ces voies de signalisations impliquant aussi des récepteurs nucléaires sont donc susceptibles d’influencer l’horloge via Rev-erb α. Cl: Clock ; B: Bmal1 ; Cr: Cry ; P: Per ; R: Rev-erb α ; ~: transcription; →: activation; ┤;: inhibition. |
|
1. Panda S, Hogenesh JB, Kay SA. Circadian rhythms from flies to humans. Nature 2002; 417: 330–5. 2. Preitner N, Damiola F, Lopez-Molina L, et al. The orphan nuclear receptor REV-ERBα controls circadian transcription within the positive limb of the mammalian circadian oscillator. Cell 2002; 110: 251–60. 3. Lee C, Etchegaray JP, Cagampang FRA, Loudon ASI, Reppert SM. Posttranslational mechanisms regulate the mammalian circadian clock. Cell 2001; 107: 855–67. 4. Reppert SM, Weaver DR. Coordination of circadian timing in mammals. Nature 2002; 418: 935–41. 5. Yu W, Nomura R, Ikeda M. Interacting feedback loops within the mammalian clock: BMAL1 is negatively autoregulated and upregulated by CRY1, CRY2 and PER2. Biochem Biophys Res Commun 2002; 290: 933–41. 6. Chomez P, Neveu I, Mansen A, et al. Increased cell death and delayed development in the cerebellum of mice lacking the rev-erbA(α) orphan receptor. Development 2000; 127: 1489–98. 7. Balsalobre A, Damiola F, Schibler U. A serum shock induces circadian gene expression in mammalian tissue culture cells. Cell 1998; 93: 929–37. 8. Torra IP, Tsibulsky V, Delaunay F, et al. Circadian and glucocorticoid regulation of Rev-erbα expression in liver. Endocrinology 2000; 141: 3799–806. 9. Delaunay F, Thisse C, Marchand O, Laudet V, Thisse B. An inherited functional circadian clock in zebrafish embryos. Science 2000; 289: 297–300. 10. André E, Conquet F, Steinmayr M, Stratton SC, Porciatti V, Becker-André M. Disruption of retinoidrelated orphan receptor β changes circadian behavior, causes retinal degeneration and leads to vacillans phenotype in mice. EMBO J 1998; 17: 3867–77. 11. Balsalobre A, Brown SA, Mercacci L, et al. Resetting of circadian time in peripheral tissues by glucocorticoid signaling. Science 2000; 289: 2344–7. 12. McNamara P, Seo SP, Rudic RD, Seghal A, Chakravarti D, Fitzgerald GA. Regulation CLOCK and MOP4 by nuclear hormone receptors in the vasculature: a humoral mechanism to reset a peripheral clock. Cell 2001;105: 877–89 13. Panda S, Antoch MP, Miller BH, et al. Coordinated transcription of key pathways in the mouse by the circadian clock. Cell 2002; 109: 307–20. 14. Storch KF, Lipan O, Viswanathan N, Davis FC, Wong WH, Weitz CJ. Extensive and divergent circadian expression in liver and heart. Nature 2002; 417: 78–83. 15. Ueda HR, W. C, Adachi A, Wakamatsu H, et al. A transcription factor response element for gene expression during circadian night. Nature 2002; 418: 534–9. |