| |
| Med Sci (Paris). 2003 December; 19(12): 1259–1264. Published online 2003 December 15. doi: 10.1051/medsci/200319121259.Le gène p8 est nécessaire au développement tumoral Sophie Vasseur* and Juan L. Iovanna 1Inserm EMI 0116,163, avenue de Luminy, Parc Scientifique et Technologique de Luminy, BP 172, 13009 Marseille, France |
Les cellules tumorales s’évadant d’un cancer primitif ne forment pas de métastases dans tous les tissus. Ce processus est sélectif et dépend à la fois des interactions que la cellule pourra établir avec les organes cibles et des facteurs environnementaux auxquels elle sera exposée [
1,
2]. Il est probable que le développement d’une métastase dépende de la capacité de la cellule tumorale à s’établir et à se multiplier dans l’organe cible [2–
5]. En fait, l’évolution d’un cancer se déroule en plusieurs étapes. Au sein de la tumeur primitive, certaines cellules sont d’abord sélectionnées sur la base de leur croissance rapide, de leur faible réponse aux signaux apoptotiques et de leur capacité à échapper à la surveillance immunitaire de l’hôte. Les cellules tumorales quittent ensuite la tumeur primitive et migrent à travers l’organisme. Elles doivent alors être capables d’envahir les organes, ce qui n’est pas toujours le cas. Enfin, et c’est l’étape qui nous intéresse particulièrement ici, elles doivent pouvoir s’y établir pour former une métastase. Cela ne se produira que si les cellules tumorales sont capables de résister à leur nouveau micro-environnement. En effet, le phénotype de la cellule tumorale est adapté à l’environnement d’origine, celui de l’organe dans lequel s’est formé le cancer primaire. Comme l’environnement de l’organe envahi est différent de celui de l’organe d’origine, il fera subir un stress à la cellule tumorale, et la capacité de résistance à ce stress conditionnera l’aptitude de la cellule à établir une métastase. La cellule va donc activer les gènes de son programme de défense pour tenter de survivre afin de s’implanter et de proliférer. Il existe d’ailleurs plusieurs exemples de surexpression de gènes de réponse au stress dans les tumeurs [
6–
8], dont le niveau d’expression est souvent corrélé à l’agressivité tumorale. |
Caractéristiques de p8 : une nouvelle protéine de stress Le gène codant pour la protéine p8 a été cloné à la fin des années 1990. La protéine d’environ 8 kDa a été initialement identifiée grâce à sa très forte surexpression dans le pancréas au cours de la phase aiguë de la pancréatite [
9]. In vivo, plusieurs agents de stress induisent l’expression de l’ARN messager de p8 : elle est par exemple augmentée dans le pancréas, le foie et le rein par l’administration systémique de lipopolysaccharide [
10]. La capacité d’induction de p8 par le stress est donc ubiquitaire. Des stress beaucoup plus faibles sont capables d’induire l’expression du gène p8. En mettant au point un modèle cellulaire d’étude des mécanismes d’induction de p8, nous avons observé que le simple changement de milieu de culture de cellules, opération de routine, se traduit par une augmentation forte et transitoire de la synthèse de p8 dans ces cellules [
11]. Cette augmentation est due à l’absence dans le nouveau milieu de facteurs sécrétés par les cellules. Ces facteurs ne sont pas spécifiques d’un type cellulaire, puisque l’ajout de milieu conditionné provenant de lignées différentes de celles utilisées pour définir le modèle cellulaire inhibent également l’induction de p8. Ainsi, la plupart des cellules produisent ce type de facteurs, bien que l’on ignore s’il s’agit des mêmes espèces moléculaires. Par ailleurs, d’autres molécules sensibles au stress comme p38, JNK et ERK1/2 sont également activées de façon transitoire à la suite d’un renouvellement du milieu de culture. Nous avons d’ailleurs démontré que p38 est impliquée dans l’induction de p8 au cours du changement de milieu, car son inhibiteur spécifique SB203580 empêche l’expression de p8. Le gène p8 a été cloné chez l’homme, le rat, la souris et Xenopus laevis [9,
12–
14]. Des paralogues ont été trouvés par analyse des séquences présentes dans les banques de données, génomique pour Drosophila melanogaster et le poisson Fugu, ou banques d’EST pour le porc, le bœuf et le poisson zèbre, pour Xenopus tropicalis, Orzzias latipes, Bombyx mori et le Paralichthys olivaceous (Figure 1). Les calculs de prédiction de structure secondaire ont montré, dans la région fortement conservée des treize protéines, l’existence d’un motif basique hélice-boucle-hélice caractéristique de certaines classes de facteurs de transcription. Un signal de localisation nucléaire (NLS) composé de deux séquences d’acides aminés chargés positivement est également présent dans les treize protéines. D’ailleurs, une localisation majoritairement nucléaire a été observée par immunohistochimie après surexpression de la protéine p8 humaine dans des cellules Cos [12]. Nous avons récemment montré que p8 est acétylée in vitro par l’acétyltransférase p300 au niveau de ses résidus lysine. Il est possible que la localisation nucléaire de p8 soit contrôlée par l’acétylation de la protéine en conditions physiologiques, comme c’est le cas pour d’autres protéines [
15], car les deux motifs d’acétylation font partie du NLS.
 | Figure 1. Homologie des protéines p8 de différentes espèces. NLS : signal de localisation nucléaire. |
Nous avons recherché dans les bases de données l’existence de protéines homologues à p8 dont la fonction serait connue, sans succès. Cependant, p8 présente des caractéristiques biochimiques analogues à celles des protéines HMG [
16], en particulier celles de la famille HMG-I/Y. En effet, chez l’homme, bien que le pourcentage d’identité entre p8 et les protéines HMG-I/Y soit seulement de 35 %, les masses moléculaires, les points isoélectriques, les pourcentages en Arg+Lys, Glu+Asp, Ser+Thr, Gly+Pro, les profils d’hydrophilicité ainsi que la ségrégation des charges sont très semblables. Une autre caractéristique commune à p8 et aux HMG est qu’elles ne sont ni dénaturées à 100° C, ni précipitables à l’acide trichloracétique à 2 %. Enfin, elles sont toutes deux acétylables au niveau de leur séquence NLS [16]. Les expériences de retard sur gel indiquent une faible association de p8 avec l’ADN, sans spécificité de séquence particulière. Cependant, la protéine p8 humaine est un substrat de la protéine kinase A in vitro, et la forme phosphorylée de p8 présente une meilleure interaction avec l’ADN, comme le montrent les études par dichroïsme circulaire et par retard sur gel [16]. L’ensemble de ces données suggèrent pour p8 un rôle dans le maintien de l’architecture du complexe transcriptionnel, semblable à celui des protéines HMG-I/Y avec lesquelles elle partage donc de nombreux points communs. |
p8, une molécule à fonctions multiples ? p8 et le cycle cellulaire Lorsqu’une cellule est soumise à une situation de stress, des voies de régulation cellulaire sont activées et un profond remaniement de l’expression des gènes survient. Un programme d’expression génique adapté à la nouvelle situation de stress va être démarré pour que la cellule, dans le meilleur des cas, surmonte cette crise et poursuive son cycle cellulaire ou, dans le cas contraire, interrompe son cycle cellulaire ou entre en apoptose. Les gènes activés par le stress, en particulier p8, jouent un rôle important dans le devenir de la cellule. Grâce à la production de souris transgéniques dans lesquelles le gène p8 a été inactivé, nous avons obtenu des fibroblastes p8−/− dont nous avons étudié le comportement in vitro. Les fibrolastes p8−/− poussent plus rapidement que les fibroblastes normaux parce qu’ils contiennent des niveaux intracellulaires et des activités des kinases Cdk2 et Cdk4 plus importants. L’augmentation de ces taux dans les fibroblastes p8−/− pourrait s’expliquer par la baisse d’expression de l’inhibiteur de kinases cycline-dépendantes p27. Nous avons également constaté que l’interruption du cycle cellulaire est accompagnée d’une augmentation de l’expression de p8. L’arrêt du cycle cellulaire consécutif à une privation de sérum est d’ailleurs plus marqué dans les fibroblastes normaux que chez les fibroblastes p8−/− [
17]. Il semble donc probable que p8 soit impliquée dans le mécanisme d’interruption du cycle cellulaire. Par ailleurs, les fibroblastes normaux sont plus sensibles que les fibroblastes p8−/− à l’apoptose induite par une lésion de l’ADN. En plus de faciliter l’arrêt du cycle cellulaire, p8 augmenterait donc la susceptibilité cellulaire à l’apoptose, deux processus dans lesquels intervient p53 [
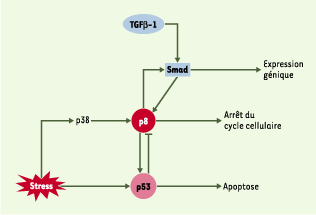
18]. Enfin, une boucle d’autorégulation entre p8 et p53 a été démontrée : p8 contribue à l’activité transcriptionelle de p53, alors que p53 réprime l’expression de p8. Le mécanisme moléculaire de répression de l’expression de p8 (Figure 2) par p53 reste cependant inconnu. 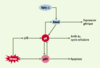 | Figure 2. Complexité de la fonction de la protéine p8. La protéine p8 est induite par le TGFb, et augmente elle-même l’expression des gènes cibles du TGFb ; p8 est un médiateur de l’apoptose induite par p53 ; p8 est impliquée dans la régulation du cycle cellulaire. |
p8 et le TGFb En recherchant des médiateurs de l’activation du gène p8 parmi les cytokines et les facteurs de croissance, nous avons observé que le TGFb induit fortement ce gène [
19]. Les membres de la famille TGFb sont des cytokines sécrétées par de nombreux types cellulaires, et interviennent dans différents processus comme la prolifération, la différenciation et la formation de la matrice extracellulaire [
20]. Les membres de la famille TGFb agissent par l’intermédiaire de récepteurs transmembranaires possédant une activité sérine/thréonine kinase qui induit la propagation du signal par la voie Smad. Les protéines Smad, substrats des récepteurs, constituent une famille de facteurs de transcription très conservée dans l’évolution. L’activation du récepteur TGFb provoque la phosphorylation des Smad 2 et 3 qui forment alors un complexe avec le médiateur commun Smad 4. Ce complexe migre vers le noyau, où il intervient dans la régulation de la transcription : en recrutant des facteurs de liaison à l’ADN et des facteurs de transcription pour former un complexe transcriptionnel, le complexe permet l’expression des gènes cibles. La protéine p8 intervient-elle dans le processus de signalisation cellulaire activé par le TGFb ? Les cellules p8−/− sont moins sensibles au traitement par le TGFb et la capacité transactivatrice des Smad est réduite dans ces cellules. Si l’on restaure l’expression de p8 dans les cellules déficientes, l’activité Smad est alors totalement récupérée. Ces résultats laissent donc supposer que p8 agit comme cofacteur des protéines Smad. De plus, trois séquences consensus de liaison au complexe Smad sont présentes dans le promoteur du gène p8, dont une dans l’élément de réponse C/EBP (CCAAT/enhancer binding protein) en position -111. Nous avons d’ailleurs démontré que cet élément de réponse au C/EBPb est indispensable pour l’expression du gène p8, faisant du facteur de transcription C/EBPb un activateur majeur de la transcription du gène. La régulation de l’expression de p8 pourrait donc se faire via une coopération entre Smad et C/EBP, comme cela a déjà été montré pour d’autres gènes. Ainsi, on peut conclure que p8 participe à la voie de transduction du signal TGFb. Une hypothèse attrayante serait que le TGFb active l’expression de p8, qui à son tour induirait l’activité Smad responsable de la réponse au TGFb. La liaison de ce dernier sur son récepteur provoque la phosphorylation des protéines Smad qui, en migrant dans le noyau, règlent la transcription des gènes cibles du TGFb, dont p8. À la suite de cette activation, p8 participerait à son tour à la stabilisation du complexe transcriptionnel Smad, comme cela a été suggéré pour les protéines HMG [16], et permettrait la propagation du signal médié par le TGFb (Figure 2). |
Importance de p8 dans la progression tumorale p8 est une protéine de stress surexprimée dans plusieurs types de cancers [
21–
23]. Elle pourrait donc jouer un rôle important dans le processus métastatique en facilitant l’adaptation des cellules tumorales à de nouveaux environnements. Des études menées indépendamment par une équipe norvégienne ont montré que la protéine Com1 [
24], qui est identique à p8, est impliquée dans le développement de métastases de cancer du sein. Ces résultats suggèrent que l’expression de p8 (comme celle de Com1) contrôle des fonctions cellulaires nécessaires à la progression tumorale et au développement de métastases. Afin d’obtenir des données plus précises sur le rôle de p8 dans la progression tumorale, nous avons utilisé des fibroblastes embryonnaires p8−/− et des fibroblastes de souris normales que nous avons transformés à l’aide du rétrovirus pBabe-rasV12/E1A exprimant à la fois la protéine rasV12 mutée et l’oncogène adénoviral E1A. In vitro, le pouvoir tumorigène des fibroblastes p8+/+ et p8−/− a été comparé en mesurant leur capacité à former des colonies en gel d’agar. Comme prévu, les fibroblastes p8+/+ transformés forment un grand nombre de colonies. En revanche, les fibroblastes p8−/− transformés n’en ont formé aucune, se comportant comme les fibroblastes p8+/+ non transformés. Des résultats analogues ont été obtenus in vivo, les fibroblastes transformés p8+/+ injectés sous la peau de souris athymiques formant des tumeurs, mais pas les fibroblastes transformés déficients en p8 (Figure 3). De la même façon, l’injection intrapéritonéale de fibroblastes transformés p8+/+ conduit à un envahissement de la cavité péritonéale par les cellules tumorales, mais aucune tumeur n’est observée dans le cas des fibroblastes transformés p8−/−. La restauration de l’expression de p8 dans les fibroblastes transformés p8−/− leur rend la capacité à former des tumeurs de la même manière que les fibroblastes transformés p8+/+. L’ensemble de ces résultats indiquent que l’expression de p8 est nécessaire à la formation des tumeurs [
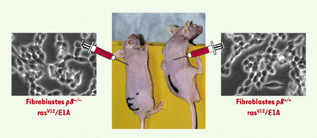
25].  | Figure 3. La protéine p8 est indispensable à la progression tumorale. Des fibroblastes p8−/− et p8+/+ ont été transformés à l’aide d’un rétrovirus exprimant la protéine ras mutée et l’oncogène adénoviral E1A, puis injectés à des souris athymiques. Seules les cellules exprimant la protéine p8 ont engendré des tumeurs. |
Le mécanisme par lequel p8 permet la progression tumorale est encore inconnu. Cependant, la molécule est associée au stress. L’activation de p8 observée dans les cellules p8+/+ transformées au cours de la formation de tumeurs sous-cutanées ou intrapéritonéales [25] est donc la conséquence probable du stress engendré par le nouveau microenvironnement de ces cellules. Notre hypothèse est que les fibroblastes p8−/− transformés seraient incapables de former des tumeurs car ils ne résistent pas au stress environnemental. Les données cliniques disponibles vont dans ce sens, d’une part car il existe une corrélation entre le niveau d’expression de p8 dans les cancers du sein et du pancréas et l’agressivité de ces cancers [
22, 23], et d’autre part parce que p8 est fortement exprimée dans les métastases [24]. D’autres études sont nécessaires pour démontrer que les cellules incapables de gérer un stress sont également incapables de former des métastases mais, si cela s’avérait, de nouvelles stratégies thérapeutiques du cancer pourraient en découler. Il est bien connu par ailleurs que la cellule tumorale produit en grande quantité du TGFb qui favorise la croissance de la tumeur en augmentant ses capacités d’invasion du tissu cible et en modifiant le micro-environnement de la tumeur. Le TGFb stimule également la production de protéines de la matrice extracellulaire lors du développement de la tumeur et favorise la chimio-attraction de fibroblastes sur le site de la tumeur. L’angiogenèse tumorale est un autre phénomène majeur indispensable pour la progression des tumeurs et dans lequel le TGFb joue également un rôle clé. Or, nous avons vu que l’expression de p8 est activée par le TGFb. Dans la cascade des voies déclenchées par le TGFb lors de la formation des tumeurs, p8, en s’associant aux protéines Smad, pourrait alors participer à un complexe transcriptionnel pour régler la transcription de gènes cibles impliqués dans le déroulement des phénomènes décrits ci-dessus, indispensables à la tumorigenèse. On sait, d’ailleurs, que la machinerie transcriptionnelle des Smad recrute des co-activateurs additionnels réglant finement l’amplitude de l’activation de certains gènes. La protéine p8 pourrait être l’un de ces co-activateurs. |
L’ensemble des données recueillies suggère que la protéine p8 agit en tant que facteur de transcription dans la voie conduisant à la tumorigenèse. Comme les HMG, p8 permettrait, lorsque la cellule est soumise à une situation de stress, une stabilisation de la chromatine dans les zones où la transcription de gènes cibles est très active. Dans le cas des tumeurs, l’expression de p8 faciliterait la transcription de gènes indispensables à la progression tumorale. Une comparaison préliminaire, par microarray (puces à ADN), des profils d’expression génique de cellules p8+/+ et p8−/− transformées a d’ailleurs déjà montré que la régulation des gènes est fortement altérée dans les cellules p8−/− transformées. En effet, les fibroblastes déficients en p8 n’expriment pas correctement les gènes modifiés par la transformation. Il semble donc que, en l’absence de p8, la réponse de la cellule transformée face au stress ne soit pas suffisante. Le nouveau programme d’expression génique est incorrect et ne permet pas à la cellule tumorale de déclencher les signaux nécessaires pour envahir le tissu cible et pour proliférer jusqu’à la formation de la tumeur et de métastases. Dans ce contexte, il est possible que p8 se positionne comme un nouveau gène cible dont l’inhibition pourrait empêcher la formation de métastases. |
1. Fidler IJ. Modulation of the organ microenvironment for treatment of cancer metastasis. J Natl Cancer Inst 1995; 87 : 1588–92. 2. Uhr JW, Scheuermann RH, Street NE, Vitetta ES. Cancer dormancy : opportunities for new therapeutic approaches. Nat Med 1997; 3 : 505–9. 3. Holmgren L, O’Reilly MS, Folkman J. Dormancy of micrometastases : balanced proliferation and apoptosis in the presence of angiogenesis suppression. Nat Med 1995; 1 : 149–53. 4. Luzzi KJ, MacDonald IC, Schmidt EE, et al. Multistep nature of metastatic inefficiency : dormancy of solitary cells after successful extravasation and limited survival of early micrometastases. Am J Pathol 1998; 153 : 865–73. 5. Kerbel RS. Significance of tumor-host interactions in cancer growth and metastases. Cancer Metastasis Rev 1995; 14 : 259–62. 6. Storm FK, Mahvi DM, Gilchrist KW. Heat shock protein 27 overexpression in breast cancer lymph node metastasis. Ann Surg Oncol 1996; 3 : 570–3. 7. Jamora C, Dennert G, Lee AS. Inhibition of tumor progression by suppression of stress protein GRP78/BiP induction in fibrosarcoma B/C10ME. Proc Natl Acad Sci USA 1996; 93 : 7690–4. 8. Davis RJ. Signal transduction by the JNK group of MAP kinases. Cell 2000; 103 : 239–52. 9. Mallo GV, Fiedler F, Calvo EL, et al. Cloning and expression of the rat p8 cDNA, a new gene activated in pancreas during the acute phase of pancreatitis, pancreatic development, and regeneration, and which promotes cellular growth. J Biol Chem 1997; 272 : 32360–9. 10. Jiang YF, Vaccaro MI, Fiedler F, Calvo EL, Iovanna JL. Lipopolysaccharides induce p8 mRNA expression in vivo and in vitro. Biochem Biophys Res Commun 1999; 260 : 686–90. 11. Garcia-Montero A, Vasseur S, Mallo GV, Soubeyran P, Iovanna J. Expression of the stress-induced p8 mRNA is transiently activated after culture medium change. Eur J Cell Biol 2001; 80 : 720–5. 12. Vasseur S, Vidal Mallo G, Fiedler F, et al. Cloning and expression of the human p8, a nuclear protein with mitogenic activity. Eur J Biochem 1999; 259 : 670–5. 13. Vasseur S, Mallo GV, Garcia-Montero A, et al. Structural and functional characterization of the mouse p8 gene : promotion of transcription by the CAAT-enhancer binding protein alpha (C/EBPalpha) and C/EBPbeta trans-acting factors involves a C/EBP cis-acting element and other regions of the promoter. Biochem J 1999; 343 : 377–83. 14. Igarashi T, Kuroda H, Takahashi S, Asahima M. Cloning and characterization of the Xenopus laevis p8 gene. Dev Growth Differ 2001; 43 : 693–8. 15. Soutoglou E, Katrakili N, Talianidis I. Acetylation regulates transcription factor activity at multiple levels. Mol Cell 2000; 5 : 745–51. 16. Encinar JA, Mallo GV, Mizyrycki C, et al. Human p8 is a HMG-I/Y-like protein with DNA binding activity enhanced by phosphorylation. J Biol Chem 2001; 276 : 2742–51. 17. Vasseur S, Hoffmeister A, Garcia-Montero A, et al. p8-deficient fibroblasts grow more rapidly and are more resistant to adriamycin-induced apoptosis. Oncogene 2002; 21 : 1685–94. 18. Amundson SA, Myers TG, Fornace AJ. Roles for p53 in growth arrest and apoptosis : putting on the brakes after genotoxic stress. Oncogene 1998; 17 : 3287–99. 19. Garcia-Montero AC, Vasseur S, Giono LE, et al. Transforming growth factor beta-1 enhances Smad transcriptional activity through activation of p8 gene expression. Biochem J 2001; 357 : 249–53. 20. Derynck R, Akhurst RJ, Balmain A. TGF-beta signaling in tumor suppression and cancer progression. Nat Genet 2001; 29 : 117–29. 21. Su SB, Motoo Y, Iovanna JL, et al. Expression of p8 in human pancreatic cancer. Clin Cancer Res 2001; 7 : 309–13. 22. Su SB, Motoo Y, Iovanna JL, et al. Overexpression of p8 is inversely correlated with apoptosis in pancreatic cancer. Clin Cancer Res 2001; 7 : 1320–4. 23. Ree AH, Pacheco MM, Tvermyr M, Fodstad O, Brentani MM. Expression of a novel factor, com1, in early tumor progression of breast cancer. Clin Cancer Res 2000; 6 : 1778–83. 24. Ree AH, Tvermyr M, Engebraaten O, et al. Expression of a novel factor in human breast cancer cells with metastatic potential. Cancer Res 1999; 59 : 4675–80. 25. Vasseur S, Hoffmeister A, Garcia S, Bagnis C, Dagorn JC, Iovanna JL. p8 is critical for tumour development induced by rasV12 mutated protein and E1A oncogene. EMBO Rep 2002; 3 : 165–70. |