| |
| Med Sci (Paris). 2003 November; 19(11): 1081–1090. Published online 2003 November 15. doi: 10.1051/medsci/200319111081.La génétique de l’autisme Stéphane Jamain,1* Catalina Betancur,2 Bruno Giros,2 Marion Leboyer,3 and Thomas Bourgeron1 1Laboratoire de génétique humaine et fonctions cognitives, Université Paris 7, Inserm EPI21, Institut Pasteur, 25, rue du Docteur Roux, 75724 Paris Cedex 15, France 2Inserm U.513, Neurobiologie et Psychiatrie, Faculté de Médecine, 8, rue du Général Sarrail, 94010 Créteil Cedex, France 3Inserm U.513, Service de Psychiatrie Adulte, Hôpitaux Albert Chenevier et Henri Mondor, Assistance Publique-Hôpitaux de Paris, 40, rue de Mesly, 94000 Créteil, France |
L’autisme fut défini par Léo Kanner en 1943 comme un «trouble du contact affectif » [
1]. Aujourd’hui, ce syndrome est classé parmi les troubles envahissants du développement; il est caractérisé par des déficits dans les interactions sociales et la communication, associés à un répertoire de comportements restreint, répétitif et stéréotypé [
2]. Les comportements autistiques apparaissent chez l’enfant avant l’âge de trois ans. On estime aujourd’hui qu’environ un enfant sur 1 000 est atteint d’autisme. Cette prévalence a beaucoup augmenté ces dernières années, puisqu’elle est passée de 2 à 5/10 000 jusqu’à la fin des années 1990, à 1/1 000 aujourd’hui [
3]. Cette augmentation est expliquée par une modification des critères diagnostiques [2] destinée à améliorer et uniformiser la définition du phénotype d’autisme. Cette homogénéisation passe par l’utilisation des mêmes outils par tous les pra-ticiens, notamment l’ADI-R (autism diagnostic interview-revised) [
4]. En dépit de cette évolution, une particularité persiste, puisque l’on observe toujours quatre fois plus de garçons atteints que de filles. Parmi les caractéristiques cliniques les plus fréquemment associées à l’autisme, on retrouve les retards mentaux (75% des cas ont un QI < 70), l’épilepsie (30% des sujets autistes) et la macrocéphalie (20 % des autistes). Les études post-mortem et d’imagerie cérébrale réalisées sur des individus autistes révèlent des anomalies dans le système limbique et le cervelet, avec une diminution du nombre, de la densité et de la taille des cellules [
5]. D’autres anomalies anatomiques du cerveau ont également été décrites, comme une réduction du corps calleux ou des anomalies du tronc cérébral [5]. Les descriptions neuro-anatomiques de l’autisme sont, toutefois, très hétérogènes et les approches génétiques, complémentaires de ces études, devraient favoriser la compréhension de ce syndrome complexe. Dans ses premières descriptions, Léo Kanner notait que, dans la plupart des cas, les comportements des enfants étaient anormaux dès leur plus jeune âge, voire dès la naissance. En outre, 4,5 % des familles d’autistes possèdent plus d’un enfant atteint, signifiant que le risque de récurrence dans ces familles est 45 fois plus élevé que le risque en population générale [3]. De surcroît, les études épidémiologiques réalisées chez des couples de jumeaux mono-zygotes (MZ) et dizygotes (DZ) [3] montrent que, lorsqu’un des enfants est atteint d’autisme dans un couple de jumeaux MZ, le deuxième a une probabilité supérieure à 60 % d’être également autiste, alors que ce risque est de 0 % pour les couples de jumeaux DZ. Il ne fait aucun doute, cependant, que ce taux de 0 % observé chez les jumeaux DZ est le résultat du faible nombre de DZ autistes rapporté dans les études. Lors de ces calculs de concordance, si l’on considère plus généralement les troubles cognitifs ou sociaux chez les jumeaux d’autistes, le taux de concordance s’approche de 90 % pour les MZ et de 10 % pour les DZ. Ainsi, le rapport de concordances entre les jumeaux MZ et DZ et le risque de récurrence observé dans les familles d’autistes nous permettent de calculer un taux d’héritabilité (variance génétique/variance phénotypique) supérieur à 90 %. La différence de concordance observée entre les jumeaux MZ et DZ, l’augmentation du risque dans les fratries et les études de ségrégation familiale montrent indubitablement que l’autisme est un syndrome génétique, mais qu’il est très probablement polygénique (le phénotype est dû à l’interaction de plusieurs gènes) et qu’il présente, en outre, une hétérogénéité génétique (les gènes responsables varient d’une famille à l’autre). |
Les maladies génétiques et les anomalies chromosomiques associées à l’autisme La réalisation d’examens complémentaires permet de montrer qu’environ 15% des cas d’autisme sont associés à une maladie génétique connue comme le syndrome de l’X fragile, la sclérose tubéreuse de Bourneville ou le syndrome de Rett. Le syndrome de l’X fragile Ce syndrome est caractérisé par un retard mental plus ou moins sévère, une macro-orchidie, une mâchoire proéminente, de grandes oreilles et un déficit dans l’attention et la concentration (OMIM 309550). Il est dû à des mutations dans le gène FMR1 localisé en Xq27.3. La principale mutation, nommée fra(X), correspond à une suramplification d’une répétition du trinucléotide (CGG) n localisée dans la partie 5’ non traduite du gène FMR1, créant un site fragile sur le chromosome X (→). Avant la découverte des mutations dans le gène FMR1, la proportion de cas d’X fragile rapportée parmi les individus autistes variait d’étude en étude, allant de 0 à 50 %. Depuis l’apparition des analyses moléculaires, le syndrome de l’X fragile est retrouvé chez 4 % des sujets atteints d’autisme (→). Les distinctions phénotypiques entre ces deux syndromes n’étant pas toujours aisées, il est important de tester systématiquement tous les autistes pour la mutation fra(X), afin de limiter l’hétérogénéité du syndrome lors de la recherche de gènes de prédisposition à l’autisme idiopathique. (→) m/s 1994, n° 6-7, p. 747
(→) m/s 2003, n° 5, p. 525
La sclérose tubéreuse de Bourneville (STB) Ce syndrome autosomique dominant associe une épilepsie, des difficultés d’apprentissage, des troubles du comportement et des lésions des reins et de la peau (OMIM 191100). Il existe deux gènes TSC1 et TSC2, localisés sur les chromosomes 9q34 et 16p13, qui codent respectivement pour l’hamartine et la tubérine, et dont les mutations conduisent au développement de ce syndrome (→). Ces deux protéines doivent s’associer pour être actives; si l’une manque, le complexe ne se forme pas et entraîne la formation de tumeurs bénignes, le plus souvent au niveau du cerveau, des reins et de la peau (→). On constate qu’entre 17% et 60% des individus retardés mentaux porteurs d’une STB sont également autistes et présentent souvent une épilepsie. A contrario, le nombre de STB parmi les individus autistes est évalué entre 0,4 % et 3,0 %, et augmente à 14 % chez les sujets autistes ayant des épilepsies [
6]. Cette association semble dépendre du nombre et de la localisation des tumeurs dans le cerveau, avec une augmentation significative de la fréquence de l’autisme dans la sclérose tubéreuse lorsque l’on retrouve des lésions au niveau des lobes temporaux. Par ailleurs, certains enfants autistes présentent une hyperplasie des lobes temporaux pouvant être en partie responsable de la macrocéphalie observée chez 20 % des sujets atteints. (→) m/s 1994, n° 5, p. 601
(→) m/s 1999, n° 8-9, p. 1033
Le syndrome de Rett Ce syndrome neurologique affecte principalement les filles. Ces enfants ont habituellement un développement précoce (jusqu’à l’âge de 6 à 18 mois) apparemment normal, puis ils régressent et perdent leurs capacités de communication et d’utilisation habile de leurs mains. Ils présentent alors un retard mental, un autisme et une microcéphalie (OMIM 312750). Dans 77% des cas, cette pathologie est expliquée par une mutation dans le gène MECP2 ( methyl-CpG-binding protein 2), localisé en Xq28 (→). L’identification de ce gène a permis de mettre en évidence des mutations chez des garçons et des filles présentant des tableaux cliniques atypiques. En particulier, une analyse de la séquence de ce gène, réalisée chez des filles autistes qui n’avaient pas les manifestations classiques du syndrome de Rett, a permis d’identifier la présence d’une mutation de novo chez deux d’entre elles [
7]. Ces résultats, bien que préliminaires, suggèrent que ce gène devra désormais être exploré dans l’autisme chez les filles. (→) m/s 1999, n° 11, p. 1334
Les autres maladies génétiques L’autisme a également été associé à d’autres maladies génétiques comme la phénylcétonurie non traitée, la neurofibromatose et la trisomie 21. Cependant, pour ces maladies, les cas rapportés d’association à l’autisme sont rares, et les études ont été réalisées sur de trop petits échantillons pour quantifier ces associations [ 3]. Les anomalies chromosomiques La prévalence des anomalies chromosomiques chez les individus autistes est de 5% à 10%. En outre, des anomalies de tous les chromosomes ont été décrites au moins une fois en association avec l’autisme [
8,
9]. Parmi toutes ces anomalies, celles impliquant le bras long du chromosome 15 ainsi que celles concernant le nombre et la structure des chromosomes sexuels restent de loin les plus fréquemment rapportées. Une étude épidémiologique récente montre que sur 278 individus autistes analysés, 6 (2,2%) avaient une anomalie du chromosome 15, 6 (2,2%) un site fragile en Xq27.3 et 5 (1,8%) avaient différentes formes d’anomalies des chromosomes sexuels [ 9]. Plusieurs anomalies chromosomiques sont localisées dans les régions de susceptibilité identifiées lors des analyses systématiques du génome, et ont permis de pointer rapidement vers des régions candidates et d’identifier des gènes remaniés. |
L’approche gène candidat Avant la publication des analyses systématiques de l’ensemble du génome, les gènes candidats étaient choisis exclusivement selon leur fonction. En effet, ces gènes étaient testés soit parce qu’ils étaient responsables de maladies ou de syndromes fréquemment observés chez les individus autistes, comme les gènes NF1 (responsable de la neurofibromatose de type 1), FMR1 ou MECP2, soit parce qu’ils étaient directement impliqués dans la formation du cerveau comme l’homéogène EN2 ou le gène HOXA1. Parfois également, certains dysfonctionnements permettent de suspecter un ensemble de molécules, comme les monoamines, ainsi que leur métabolisme. Par exemple, une élévation du taux de sérotonine dans les plaquettes est observée chez environ 30 % des enfants autistes [
10], et les inhibiteurs du transporteur de la sérotonine améliorent, chez certains individus autistes, une partie des comportements ritualisés et agressifs. Cependant, les études d’association entre certains allèles du gène 5-HTT ( 5-hydroxytryptamine transporter) et l’autisme rap-portent des résultats contradictoires, et nous n’avons pu établir aucun déséquilibre de liaison, ni aucune relation entre le taux de sérotonine sanguin et les polymorphismes du gène 5-HTT [
11]. De manière générale, aucune des études fondées sur la fonction des gènes n’a permis de trouver de véritable corrélation entre les variations de ces gènes et le syndrome autistique. Aujourd’hui, les meilleurs gènes candidats sont ceux situés dans les régions de prédisposition détectées par les analyses de liaison, ou les gènes altérés par des remaniements chromosomiques. Les analyses de liaison À ce jour, sept consortiums ont réalisé des analyses de liaison non paramétriques sur l’ensemble du génome, en utilisant des familles d’autistes ayant au moins deux enfants atteints [
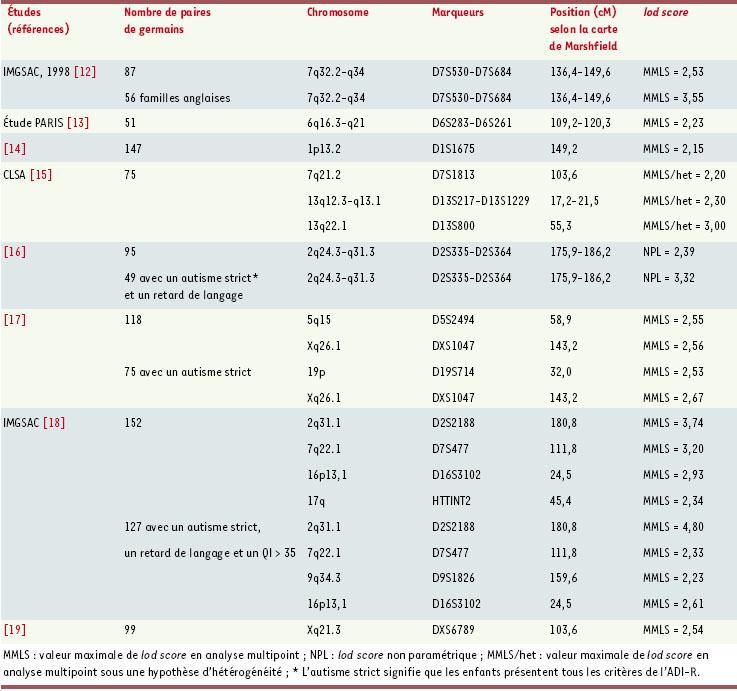
12–
19] (Figure 1). Parmi les résultats obtenus par ces études (Tableau I et Figure 2), des locus de susceptibilité sur les chromosomes 2q, 7q, 16p, 19p, 19q et Xq ont été retrouvés plusieurs fois de manière indépendante ( maximum lod score:MLS ≥ 1) [ 12,
13,
15– 19]. Dans le but de diminuer le nombre de faux positifs dans de telles études, Lander et Kruglyak ont défini une valeur seuil de lod score de 3,6 pour considérer une liaison significative entre un marqueur et un phénotype complexe [
20]. À ce jour, ce seuil n’a été atteint qu’une seule fois pour l’autisme, par l’ International molecular genetic study of autism consortium (IMGSAC) lors de sa deuxième analyse, avec un MLS de 3,74 pour le bras long du chromosome 2 [
18]. Ce MLS passe même à 4,80 lorsqu’ils restreignent le diagnostic d’autisme aux individus présentant un retard de langage et un QI ≥ 35 (Tableau I) [ 18].  | Figure 1.
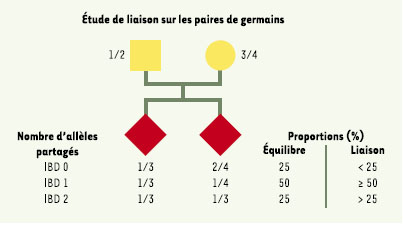
Analyse de liaison non paramétrique. Cette méthode permet d’estimer la liaison génétique entre un marqueur et le gène responsable d’un phénotype dont on ne connaît pas les paramètres de transmission, comme c’est le cas dans l’autisme. Pour ce type d’étude, il est nécessaire d’avoir accès à des familles ayant au moins deux enfants atteints. On regarde dans ces familles le pourcentage d’allèles (chaque individu possède deux allèles à chaque locus, numérotés de 1 à 4) partagés par les individus malades (IBD identity by descent). Ce type d’analyse est souvent conduit sur un nombre élevé de paires de germains atteints (affected sib-pairs). En l’absence de liaison à un locus donné, c’est-à-dire à l’équilibre, 50% des allèles seront partagés dans les fratries, avec 25 % des enfants ayant deux allèles en communs (IBD2), 50 % n’en ayant qu’un (IBD1) et 25 % ne partageant aucun allèle (IBD0). Pour chaque locus étudié, un rapport de vraisemblance d’observer de telles familles sous une hypothèse de liaison et d’indépendance génétique (LOD score) est calculé. Un excès de partage significatif indique une liaison génétique entre le marqueur étudié et l’autisme. |
 | Figure 2.
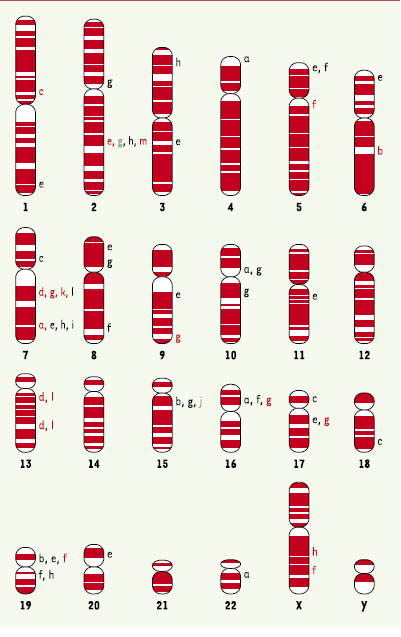
Régions candidates pour la prédisposition a l’autisme identifiées par analyse de liaison. Les valeurs de lod score (MLS) ont été représentées en vert (MLS ≥ 3,6), en rouge (MLS ≥ 2,2) ou en noir (MLS ≥ 1). Chaque lettre correspond à une étude réalisée sur l’ensemble du génome, ou sur une région chromosomique d’intérêt. Analyse de liaison sur l’ensemble du génome (a [12], b [13], c [14], d [15], e [16], f [17], g [18], h [19]); cartographies fines (i [24], j [31], k [25], l [23], m [21]). |
 | Tableau I.
Résultats des analyses de liaison pour l’autisme (seuls les lod scores suggestifs [MMLS ≥ 2,2] sont indiqués).
|
Les autres études ont montré des liaisons suggestives, dont la valeur seuil est ≥ 2,2 (lors de ces études, on s’attend à observer au moins un résultat positif par le simple fait du hasard: il s’agit alors d’un faux positif, ou d’une erreur de type 1), pour un certain nombre de locus sur les chromosomes 1p, 2q, 5q, 6q, 7q, 13q, 16p, 17q, 19p et Xq (Tableau I et Figure 2). Les chromosomes 2q, 7q et Xq sont retrouvés dans au moins deux études indépendantes avec des pics de probabilité maximale de localisation des gènes de prédisposition séparés par 20 à 50 cM [12,
16, 18]. En outre, le chromosome 7q a également été incriminé par l’observation de remaniements chromosomiques chez plusieurs sujets autistes (Figure 3).  | Figure 3.
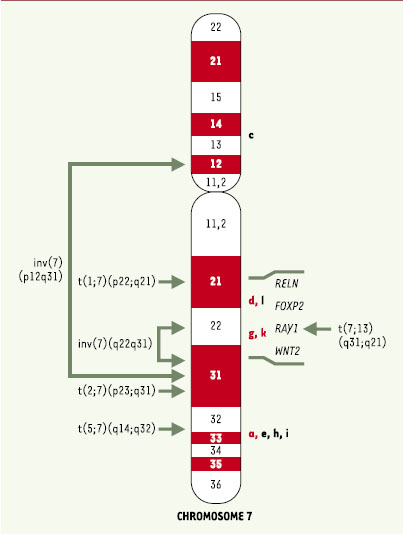
Résumé de l’ensemble des études impliquant le chromosome 7. Les pics de susceptibilité révélés par les études de liaison sont représentés par les lettres correspondant à l’étude (voir légende de la Figure 2). Les points de cassure des réarrangements chromosomiques sont symbolisés par des flèches et la position des gènes candidats est également mentionnée. Inv: inversion; t: translocation. La première parenthèse indique le (ou les) chromosome(s) impliqué(s) dans le remaniement; la seconde parenthese indique les régions de ces chromosomes qui sont remaniées. |
|
Les régions chromosomiques associées à l’autisme Le chromosome 2q24-q31 Le bras long du chromosome 2 est la seule région du génome pour laquelle un MLS significatif a été trouvé [ 18]. Ce pic est situé dans l’intervalle de susceptibilité décrit précédemment par Buxbaum et al. (Tableau I) [ 16]. En outre, une troisième étude trouve un MLS de 1,30 pour cette région [ 19]. Dans ces études, la valeur de lod score est encore plus forte lorsque les populations étudiées sont restreintes aux individus présentant un retard de langage [ 16, 18,
21]. La région identifiée s’étend sur près de 10 cM, et contient une vingtaine de gènes connus et plusieurs transcrits correspondant à des gènes non identifiés. Certains d’entre eux pourraient être de bons candidats fonctionnels, comme le gène NEUROD1, par exemple, qui agit comme facteur de différenciation durant la neurogenèse. Des études de cartographie fine, en augmentant le nombre de marqueurs microsatellites, pourraient permettre de réduire cette région de manière à déterminer les gènes les plus candidats. En outre, l’utilisation de critères cliniques plus restreints, comme le retard de langage, permettra également de travailler sur des populations plus homogènes. Le chromosome 6q16-q21 Cette région correspond à la probabilité maximale (MLS = 2,23, p = 0,0013) de localisation d’un gène de susceptibilité au syndrome autistique parmi les 51 familles étudiées dans le cadre de l’étude internationale PARIS (Paris autism research international sibpair study) que nous coordonnons [ 13]. Une cartographie fine de cette région a permis d’augmenter la valeur maximale de lod score (MLS = 3,28) et d’identifier le gène GRIK2 (glutamate receptor ionotropic kainate 2), également appelé GLUR6, comme un bon candidat fonctionnel et positionnel pour la prédisposition à l’autisme. En effet, certains allèles de ce gène sont plus fréquemment partagés par les couples de germains (frères/soeurs) atteints, en particulier lorsqu’ils sont transmis par la mère [
22]. De plus, une variation nucléotidique (M867I) et un haplotype de ce gène sont plus fréquemment transmis par les mères aux garçons autistes que le voudrait le hasard [ 22]. Dans les modèles animaux, GRIK2 a été impliqué dans la sensibilité à l’épilepsie, et la quantité de transcrits de ce gène augmente dans le cortex et l’hippocampe de certains individus épileptiques. Par conséquent, ce gène pourrait être associé à la composante épileptique du syndrome autistique présente chez 30% des sujets. Le chromosome 7q Aussi bien les analyses complètes du génome [ 12, 15, 18] que les cartographies fines réalisées sur le bras long du chromosome 7 [
17,
23–
25] ont montré la présence de deux pics de susceptibilité sur ce chromosome, séparés d’environ 25 cM et situés respectivement en 7q21-q22 et en 7q32-q34 (Tableau I et Figure 2). En outre, des remaniements chromosomiques impliquant le bras long du chromosome 7 ont été répertoriés chez au moins 7 individus autistes (Figure 3) [ 3]. Plusieurs gènes ont été testés dans la région, dont certains semblent être de très bons candidats pour la prédisposition à l’autisme. Par exemple, le gène RAY1 est directement interrompu par une cassure chromosomique chez un patient autiste avec une translocation t(7 ;13)(q31.3 ;q21) [
26]. Cependant, une analyse de la séquence codante de ce gène chez 27 patients autistes indépendants n’a montré aucun variant spécifique associé à l’autisme. Le gène RELN, codant pour la reeline, est également localisé dans la région télomérique du bras long du chromosome 7. La reeline est une protéine jouant un rôle clé dans le développement des structures laminaires telles que le cortex cérébral, l’hippocampe, le cervelet et plusieurs noyaux du tronc cérébral. En outre, le niveau sanguin de la reeline est altéré chez les individus souffrant de schizophrénie, de troubles bipolaires ou de dépressions majeures. Une étude d’association a montré un plus grand nombre de répétitions du trinucléotide GGC en 5’ du gène RELN chez les individus autistes [
27]. Bien que nous n’ayons pu les confirmer chez nos patients [
28], ces résultats sont très encourageants et devraient inciter les autres équipes à tester ce gène sur leur propre groupe de patients. Le gène WNT2 est également un bon candidat fonctionnel de la région 7q. Ce gène est situé juste à côté du gène RAY1. Il fait partie d’une grande famille de gènes exprimés au cours du développement et impliqués dans la mise en place du système nerveux central. En outre, la transmission du signal WNT est dépendante de la famille de protéines disheveled (DVL), dont l’invalidation d’un des membres (Dvl1) entraîne chez la souris une réduction des interactions sociales et des comportements maternels. Deux mutations faux-sens (L5R et R299T) ont été identifiées à l’état hétérozygote au sein de deux familles d’autistes [
29]. Dans l’une de ces familles, le père, porteur de la mutation, présente par ailleurs des anomalies de langage. Aucune de ces deux mutations n’a été retrouvée parmi 160 sujets témoins testés. En outre, un déséquilibre de liaison (DL) entre l’autisme et un polymorphisme de ce gène a été mis en évidence, principalement grâce aux familles caractérisées par de sévères anomalies de langage [29]. Enfin, dans cette région, le gène FOXP2 a récemment été impliqué dans le développement du langage et de la parole. Ce gène code pour un facteur de transcription présomptif contenant une répétition de glutamines ainsi qu’un domaine forkhead. Cependant, aucune mutation n’a, à ce jour, été identifiée dans ce gène, même lorsque les enfants présentaient de sévères troubles du langage et de la parole [
30]. Du fait de l’hétérogénéité de l’autisme, les résultats obtenus pour ces différents gènes candidats sont parfois contradictoires et même décourageants. Cependant, cette région du chromosome 7 reste de loin la région du génome la plus fréquemment associée à l’autisme. Elle n’est peut-être pas encore très bien définie et comporte probablement plusieurs gènes responsables de ce syndrome, mais les premiers résultats obtenus pour les gènes RELN et WNT2 sont très prometteurs et méritent qu’on y apporte une attention toute particulière dans les études à venir. Le chromosome 15q11-q13 Près de trente cas d’autisme porteurs d’une anomalie du chromosome 15 ont à ce jour été répertoriés [ 3]. Ces anomalies prennent souvent la forme de chromosomes 15 isodicentriques (duplications inversées du bras long du chromosome 15) ou, moins fréquemment, de duplications interstitielles de la région 15q11-q13 transmises par la mère. En outre, cette région a également été impliquée dans l’autisme par les analyses de liaison dans des familles multiplexes [ 13, 19] et lors de la réalisation de cartographies fines sur le bras long du chromosome 15 [
31]. Ce locus est soumis à empreinte parentale, avec une expression différentielle des allèles maternels et paternels. Il comprend la région classiquement délétée dans les syndromes d’Angelman et de Prader-Willi. Le syndrome d’Angelman, habituellement dû à une délétion de la région 15q11-q13 du chromosome maternel, a été associé à l’autisme chez certains individus présentant un profond retard mental [ 6]. Bien qu’avec une fréquence plus faible, l’autisme a également été associé au syndrome de Prader-Willi, pour lequel on observe classiquement des délétions au niveau du chromosome 15 transmis par le père. Des mutations du gène UBE3A, codant pour l’E6-AP ubiquitinprotein ligase, et présentes dans la majorité des syndromes d’Angelman non délétés pour la région 15q11-q13, ont été recherchées chez les patients autistes, mais aucune association n’a pu être identifiée [
32]. Les autres gènes candidats dans cette région sont le groupe de gènes codant pour les sous-unités α5, β3 et γ3 du récepteur à l’acide γ-aminobutyrique (GABAA). Le GABA est le principal neurotransmetteur inhibiteur dans le système nerveux central des mammifères, contrôlant l’excitabilité du cerveau adulte. Le système GABAergique est depuis longtemps impliqué dans l’épilepsie, aussi bien chez l’homme que dans les modèles animaux. Une transmission déséquilibrée de certains allèles du marqueur microsatellite GABRB3 155CA-2, localisé dans le 3e intron du gène GABRB3, a été mise en évidence dans certaines familles d’autistes [
33]. Cependant, bien que cette région soit soumise à empreinte parentale, aucun effet de l’origine parentale de la transmission de ces allèles n’a pu être identifié. D’autres études réalisées depuis ont montré des résultats contradictoires, mais une analyse de l’ensemble de ces résultats révèle un déséquilibre de transmission significatif [
34]. D’autres recherches sont donc nécessaires dans cette région du génome afin d’identifier quelles pourraient être les variations nucléotidiques dans le gène GABRB3, ou dans un gène proche, qui augmenteraient la prédisposition au syndrome autistique. Les chromosomes sexuels Lors de sa première description de l’autisme, Léo Kanner notait déjà un plus grand nombre de garçons (huit) que de filles (trois). Depuis, l’ensemble des études épidémiologiques rapporte qu’il y a en moyenne 4 fois plus de garçons que de filles touchés par ce syndrome [ 3]. Ce rapport s’élève à 23 garçons pour une fille dans une population d’individus autistes sans anomalie morphologique et présentant une IRM (imagerie par résonance magnétique) normale [
35]. Le chromosome X Les analyses génétiques récentes montrent une liaison suggestive entre la région Xq13-q21 et l’autisme [ 17, 19] et plusieurs anomalies chromosomiques affectent le bras court du chromosome X, et plus particulièrement la région Xp22 [
36,
37]. Ces deux régions candidates sur le chromosome X, l’une sur le bras court et l’autre sur le bras long, pourraient expliquer la différence de proportions observée entre les garçons et les filles autistes. En outre, on constate une augmentation de l’incidence de l’autisme chez les filles ayant un syndrome de Turner (45,X), essentiellement lorsque le chromosome X unique est d’origine maternel [
38]. Ces observations ont permis de supposer la présence, sur le chromosome X, d’un gène soumis à empreinte parentale et impliqué dans la cognition sociale, qui pourrait également être responsable de la prédisposition masculine à l’autisme Le chromosome Y Des anomalies de structure et de nombre du chromosome Y sont également associées à l’autisme [ 8]. Bien qu’une étude des haplotypes majeurs du chromosome Y n’ait pas permis de révéler une association entre ce chromosome et l’autisme [
39], plusieurs gènes portés par le chromosome Y sont exprimés dans le cerveau, et certains d’entre eux appartiennent à des familles de gènes jouant un rôle critique dans le développement du système nerveux. Par conséquent, ces gènes sont de bons candidats pour expliquer la prédisposition des garçons à l’autisme. |
De nombreuses observations suggèrent l’existence d’une prédisposition génétique au syndrome autistique. Toutefois, aucun gène majeur n’a encore été identifié et l’hétérogénéité des résultats obtenus lors des études de liaison suggère une grande variabilité génétique de ce syndrome. Cependant, les dernières analyses génétiques ont révélé l’existence de régions du génome associées de manière récurrente au syndrome, comme celles qui sont localisées sur les chromosomes 2q, 7q, 15q et les chromosomes sexuels. Sur la base de ces résultats, un formidable effort a été entrepris, visant à la caractérisation clinique des patients et de leurs apparentés. L’objectif est, d’une part, d’identifier chez les sujets autistes certains «symptômes candidats» tels que les retards de langage, la sévérité du retard mental, les comportements obsessionnels ou encore la présence d’une épilepsie et, d’autre part, de caractériser chez les apparentés de premier degré des endophénotypes cliniques, cognitifs ou biologiques, tels que des retards de langage ou une élévation du taux de sérotonine [
40]. Ce démembrement du phénotype autistique devrait favoriser l’identification des gènes de susceptibilité en homogénéisant au mieux les populations étudiées. Par ailleurs, les dernières données obtenues dans le séquençage du génome humain ont permis l’identification de nouveaux gènes et de leurs polymorphismes associés. Les cartes d’haplotypes, combinant l’analyse de la fréquence et celle de l’association des différentes variations nucléotidiques observées dans les populations humaines, seront disponibles dans un avenir très proche. Cette meilleure connaissance de la variabilité génétique interindividuelle facilitera les études d’association entre les polymorphismes génétiques et les phénotypes complexes tels que l’autisme. Enfin, la découverte des gènes de prédisposition à l’autisme permettra d’identifier les bases moléculaires impliquées dans l’apparition de ce syndrome (anomalies structurales, altération de certaines voies de signalisation…). Ces informations seront cruciales pour mieux caractériser l’hétérogénéité de ce syndrome, cibler les études pharmacologiques et, dans une certaine mesure, aider au diagnostic. |
Note Ajoutée Aux Épreuves Depuis la rédaction de cet article, les auteurs ont identifié, chez des individus atteints d’autisme ou du syndrome d’Asperger, deux mutations dans deux gènes (NLGN3 et NLGN4) situés sur le chromosome X, codant pour des protéines de la famille des neuroligines [
41]. La mutation dans NLGN4 correspond à une insertion d’un nucléotide prédisant un décalage du cadre de lecture et l’apparition prématurée d’un codon stop avant le domaine transmembranaire de cette protéine. Cette mutation, apparue de novo chez la mère, a été transmise aux deux garçons atteints, l’un d’autisme et l’autre du syndrome d’Asperger. Dans une autre famille, qui comprend là encore deux frères affectés l’un d’autisme et l’autre du syndrome d’Asperger, une mutation touchant le gène NLGN3, également héritée de la mère, a été identifiée. Ces gènes codent pour des molécules d’adhérence localisées au niveau de la membrane postsynaptique des synapses excitatrices. Plusieurs observations suggèrent que les neuroligines pourraient être impliquées dans les mécanismes de formation ou de maturation des synapses dans le système nerveux central des mammifères. Ainsi, l’identification de ces deux mutations associées à l’autisme et au syndrome d’Asperger dans deux familles indépendantes suggère qu’un déficit de formation ou de stabilisation de certaines populations de synapses cérébrales pourrait conduire à l’apparition de certains troubles autistiques. Ces mutations dans les neuroligines sont les premières variations véritablement associées à l’autisme idiopathique et même si ces gènes ne sont pas les seuls et uniques gènes impliqués dans l’autisme, cette étude ouvre de nouvelles pistes de recherche pour mieux comprendre ce syndrome complexe et hétérogène qu’est l’autisme. |
Les auteurs souhaitent remercier l’INSERM, l’Assistance Publique-Hôpitaux de Paris (DRC) (CRC 932413 et AOM 95076), la Fondation France Télécom et la Fondation de France pour leur soutien financier.
|
1. Kanner L. Autistic disturbances of affective contact. Nervous Child 1943; 2: 217–50. 2. American psychiatric association. Diagnostic and statistical manual of mental disorders, 4th
ed. Washington, DC: APA, 1994. 3. Folstein SE, Rosen-Sheidley B. Genetics of autism: complex aetiology for a heterogeneous disorder. Nat Rev Genet 2001; 2: 943–55. 4. Lord C, Rutter M, Le Couteur A. Autism diagnostic interviewrevised: a revised version of a diagnostic interview for caregivers of individuals with possible pervasive developmental disorders. J Autism Dev Disord 1994; 24: 659–85. 5. Piven J. The biological basis of autism. Curr Opin Neurobiol 1997; 7: 708–12. 6. Filipek PA, Accardo PJ, Baranek GT, et al. The screening and diagnosis of autistic spectrum disorders. J Autism Dev Disord 1999; 29: 439–84. 7. Ashley-Koch AE, Carney RJ, Wolpert CM, et al. Screening for MECP2 mutations in females with autistic disorder. IXth World Congress of Psychiatric Genetics. St. Louis, MO, USA, 2001. 8. Gillberg C. Chromosomal disorders and autism. J Autism Dev Disord 1998; 28: 415–25. 9. Wassink TH, Piven J, Patil SR. Chromosomal abnormalities in a clinic sample of individuals with autistic disorder. Psychiatr Genet 2001; 11: 57–63. 10. Leboyer M, Philippe A, Bouvard M, et al. Whole blood serotonin and plasma beta-endorphin in autistic probands and their firstdegree relatives. Biol Psychiatry 1999; 45: 158–63. 11. Betancur C, Corbex M, Spielewoy C, et al. Serotonin transporter gene polymorphisms and hyperserotonemia in autistic disorder. Mol Psychiatry 2002; 7: 67–71. 12. International molecular genetic study of autism consortium (IMGSAC). A full genome screen for autism with evidence for linkage to a region on chromosome 7q. Hum Mol Genet 1998; 7: 571–8. 13. Philippe A, Martinez M, Guilloud-Bataille M, et al. Genome-wide scan for autism susceptibility genes. Paris autism research international sibpair study. Hum Mol Genet 1999; 8: 805–12. 14. Risch N, Spiker D, Lotspeich L, et al. A genomic screen of autism: evidence for a multilocus etiology. Am J Hum Genet 1999; 65: 493–507. 15. Barrett S, Beck JC, Bernier R, et al. An autosomal genomic screen for autism. Collaborative linkage study of autism. Am J Med Genet 1999; 88: 609–15. 16. Buxbaum JD, Silverman JM, Smith CJ, et al. Evidence for a susceptibility gene for autism on chromosome 2 and for genetic heterogeneity. Am J Hum Genet 2001; 68: 1514–20. 17. Liu J, Nyholt DR, Magnussen P, et al. A genomewide screen for autism susceptibility loci. Am J Hum Genet 2001; 69: 327–40. 18. International molecular genetic study of autism consortium (IMGSAC). A genomewide screen for autism: strong evidence for linkage to chromosomes 2q, 7q, and 16p. Am J Hum Genet 2001; 69: 570–81. 19. Shao Y, Wolpert CM, Raiford KL, et al. Genomic screen and follow-up analysis for autistic disorder. Am J Med Genet 2002; 114: 99–105. 20. Lander E, Kruglyak L. Genetic dissection of complex traits: guidelines for interpreting and reporting linkage results. Nat Genet 1995; 11: 241–7. 21. Shao YJ, Raiford KL, Wolpert CM, et al. Phenotypic homogeneity provides increased support for linkage on chromosome 2 in autistic disorder. Am J Hum Genet 2002; 70: 1058–61. 22. Jamain S, Betancur C, Quach H, et al. Linkage and association of the glutamate receptor 6 gene with autism. Mol Psychiatry 2002; 7: 302–10. 23. Bradford Y, Haines J, Hutcheson H, et al. Incorporating language phenotypes strengthens evidence of linkage to autism. Am J Med Genet 2001; 105: 539–47. 24. Ashley-Koch A, Wolpert CM, Menold MM, et al. Genetic studies of autistic disorder and chromosome 7. Genomics 1999; 61: 227–36. 25. International molecular genetic study of autism consortium (IMGSAC). Further characterization of the autism susceptibility locus AUTS1 on chromosome 7q. Hum Mol Genet 2001; 10: 973–82. 26. Vincent JB, Herbrick JA, Gurling HM, Bolton PF, Roberts W, Scherer SW. Identification of a novel gene on chromosome 7q31 that is interrupted by a translocation breakpoint in an autistic individual. Am J Hum Genet 2000; 67: 510–4. 27. Persico AM, D’Agruma L, Maiorano N, et al. Reelin gene alleles and haplotypes as a factor predisposing to autistic disorder. Mol Psychiatry 2001; 6: 150–9. 28. Krebs MO, Betancur C, Leroy S, et al. Absence of association between a polymorphic GGC repeat in the 5’ untranslated region of the reelin gene and autism. Mol Psychiatry 2002; 7: 801–4. 29. Wassink TH, Piven J, Vieland VJ, et al. Evidence supporting WNT2 as an autism susceptibility gene. Am J Med Genet 2001; 105: 406–13. 30. Newbury DF, Bonora E, Lamb JA, et al. FOXP2 is not a major susceptibility gene for autism or specific language impairment. Am J Hum Genet 2002; 70: 1318–27. 31. Bass MP, Menold MM, Wolpert CM, et al. Genetic studies in autistic disorder and chromosome 15. Neurogenetics 2000; 2: 219–26. 32. Veenstra-VanderWeele J, Gonen D, Leventhal BL, Cook EH, Jr. Mutation screening of the UBE3A/E6- AP gene in autistic disorder. Mol Psychiatry 1999; 4: 64–7. 33. Cook EH, Courchesne RY, Cox NJ, et al. Linkagedisequilibrium mapping of autistic disorder, with 15q11-13 markers. Am J Hum Genet 1998; 62: 1077–83. 34. Buxbaum JD, Silverman JM, Smith CJ, et al. Association between a GABRB3 polymorphism and autism. Mol Psychiatry 2002; 7: 311–6. 35. Miles JH, Hillman RE. Value of a clinical morphology examination in autism. Am J Med Genet 2000; 91: 245–53. 36. Ishikawa-Brush Y, Powell JF, Bolton P, et al. Autism and multiple exostoses associated with an X;8 translocation occurring within the GRPR gene and 3’ to the SDC2 gene. Hum Mol Genet 1997; 6: 1241–50. 37. Thomas NS. Xp deletions associated with autism in three females. Lancet 1999; 353: 541–5. 38. Skuse DH, James RS, Bishop DV, et al. Evidence from Turner’s syndrome of an imprinted X-linked locus affecting cognitive function. Nature 1997; 387: 705–8. 39. Jamain S, Quach H, Quintana-Murci L, et al. Y chromosome haplogroups in autistic subjects. Mol Psychiatry 2002; 7: 217–9. 40. Goussé V, Plumet MH, Chabane N, Mouren- Siméoni MC, Ferradian N, Leboyer M. Fringe phenotypes in autism: review of clinical, biochemical and cognitive studies. Eur Psychiatry 2002; 17: 1–9. 41. Jamain S, Quach H, Betancur C, et al. Mutations of the X-linked genes encoding neuroligins NLGN3 and NLGN4 are associated with autism. Nat Genet 2003; 34 : 27–9. |